8.下列有关糖类、油脂、蛋白质的说法正确的是( )
| A. | 蛋白质中只含C、H、O三种元素 | |
| B. | 许多油脂兼有烯烃和酯的性质,可以发生加成反应和水解反应 | |
| C. | 糖类的主要成分是高级脂肪酸甘油酯 | |
| D. | 所有糖、油脂、蛋白质都能发生水解反应 |
7.下列物质中,既含有极性共价键,又含有非极性共价键的是( )
| A. | CCl4 | B. | C2H4 | C. | CO2 | D. | NH4Cl |
6.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1molNa2O2固体中含离子总数为4NA | |
| D. | 丙烯(CH2=CH-CH3)和环丙烷组成的42g混合气体中氢原子的个数为6NA |
5.下列说法正确的是( )
| A. | 聚乙烯可发生加成反应 | |
| B. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| C. | 乙烯和苯都能与溴水反应 | |
| D. | 乙烯和乙烷都能发生加成反应 |
4.一定温度下,可逆反应:A(g)+3B(g)?2C(g)在一密闭恒容容器内达到平衡的标志是( )
| A. | 容器内气体C的物质的量不再改变 | |
| B. | 容器内混合气体的A、B、C的浓度之比为1:3:2 | |
| C. | 单位时间内生成 n mol的A,同时消耗2n mol的C | |
| D. | 正、逆反应均不再进行 |
2.下列判断正确的是( )
| A. | 可用催化氢化法除去甲烷中的少量乙烯 | |
| B. | 苯与液溴反应,苯与H2反应属于同一类型的反应 | |
| C. | 苯不能使KMnO4溶液褪色,所以苯不能发生氧化反应 | |
| D. | 丙炔可以发生取代反应,加成反应、加聚反应 |
1.“类推”是思维的一种形式,但往往也有不对的,下列“类推”中正确的是( )
| A. | Fe、Cu连接插在稀硫酸中形成的原电池,Fe为负极;那么Fe、Cu连接插在浓硝酸溶液中形成的原电池,Fe也为负极 | |
| B. | HBr的沸点比HCl高,那么HCl的沸点比HF高 | |
| C. | 硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解,那么浓硝酸溶液也要保存在棕色试剂瓶中 | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
20.浩瀚的海洋是一个巨大的宝库,海水就是一项等待开发的资源.海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3- 等离子.合理利用水资源是持续发展的重要保证.
Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如下图所示:
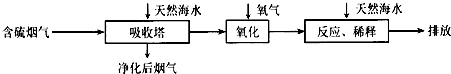
(1天然海水pH≈7.9,呈弱碱性.用离子方程式解释其原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(写一个).
(2)天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应原理的化学反应方程式是2H2SO3+O2=2H2SO4;氧化后的海水需要加入氢氧化钠,与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
Ⅱ:微量的重金属污染,可以通过生物链作用而产生富集.当人因为饮用或食用受重金属污染的水和食物,体内重金属含量过高时,便会导致各种疾病.某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子.有关数据如下:
(3)在废水排放前,用沉淀法除去这两种离子,应该加入B(填字母序号)最好
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)某工程师用CaO处理上述废水,最终溶液的pH=8,请你计算处理后废水中Pb2+的浓度为1.2×10-9mol•L-1.
0 169045 169053 169059 169063 169069 169071 169075 169081 169083 169089 169095 169099 169101 169105 169111 169113 169119 169123 169125 169129 169131 169135 169137 169139 169140 169141 169143 169144 169145 169147 169149 169153 169155 169159 169161 169165 169171 169173 169179 169183 169185 169189 169195 169201 169203 169209 169213 169215 169221 169225 169231 169239 203614
Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如下图所示:

(1天然海水pH≈7.9,呈弱碱性.用离子方程式解释其原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(写一个).
(2)天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应原理的化学反应方程式是2H2SO3+O2=2H2SO4;氧化后的海水需要加入氢氧化钠,与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
Ⅱ:微量的重金属污染,可以通过生物链作用而产生富集.当人因为饮用或食用受重金属污染的水和食物,体内重金属含量过高时,便会导致各种疾病.某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子.有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)某工程师用CaO处理上述废水,最终溶液的pH=8,请你计算处理后废水中Pb2+的浓度为1.2×10-9mol•L-1.
 .
.