4.若发现116号元素X,其最外层电子数为6,则下列叙述正确的是( )
| A. | X可以形成钠盐,其化学式为NaX | B. | X的最高价氧化物的水化物是强酸 | ||
| C. | X的最高价氧化物的化学式为XO3 | D. | X的单质能与H2直接发生化学反应 |
3.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| B. | 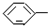 CH=CH 2是苯的同系物 CH=CH 2是苯的同系物 | |
| C. | 苯、油均不能使酸性KMnO4溶液褪色 | |
| D. | 人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用 |
2.含氧酸的元数等于羟基氢的个数,氢氧化钠只能中和连在氧上的羟基氢,磷元素有多种含氧酸,如次磷酸(H3PO2)、亚磷酸(H3P03)、磷酸等,它们分别为一元、二 元、三元弱酸或中强酸.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
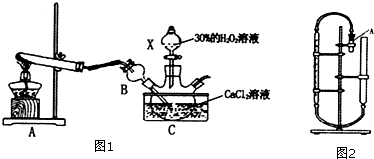
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.
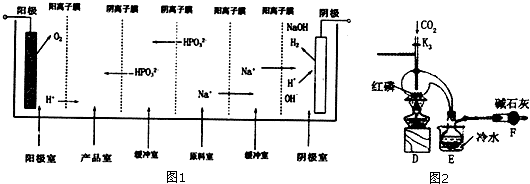
(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
请回答:
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.

(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PC13 | -112 | 75.5 |
| POCI3 | 2 | 105.3 |
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
4.下列4种有机化合物中,能够发生酯化、加成和氧化3种反应是( )
| A. | CH2=CHCOOH | B. | CH2=CHCOOCH3 | C. | CH2=CHCH2OH | D. | CH3CH2CH2OH |
3.关于油脂在人体中的生理功能的理解中正确的是( )
| A. | 油脂在人体内的水解、氧化可释放能量,所以油脂可在人体内提供能量 | |
| B. | 为人体合成其他化合物提供原料 | |
| C. | 保持体温,保护内脏器官 | |
| D. | 促进脂溶性维生素A、D、E、K等物质的吸收 |
2.下列说法正确的是( )
①沸点比较:丙烷>乙烷>甲烷
② 互为同分异构体.
互为同分异构体.
③钠与乙醇的反应,液溴与苯的反应均可属于取代反应.
④丁烷与异丁烷互为同系物.
⑤甲烷和苯不能使酸性KMnO4溶液褪色,裂化汽油能使酸性KMnO4溶液褪色.
①沸点比较:丙烷>乙烷>甲烷
②
 互为同分异构体.
互为同分异构体.③钠与乙醇的反应,液溴与苯的反应均可属于取代反应.
④丁烷与异丁烷互为同系物.
⑤甲烷和苯不能使酸性KMnO4溶液褪色,裂化汽油能使酸性KMnO4溶液褪色.
| A. | 全部 | B. | ①②③⑤ | C. | ①③⑤ | D. | ②③④ |
1.下列物质中,在一定条件下既发生银镜反应,又能发生水解反应的是( )
| A. | 甲酸甲酯 | B. | 淀粉 | C. | 葡萄糖 | D. | 纤维素 |
20.金属元素和人体健康有很大关系.钾元素可以调节体液平衡,维持肌肉和神经的功能及代谢.如果人体缺钾会出现肌肉不发达、心律不齐等症状.市场上出售的一种叫做果味钾的补钾药,其主要成分是柠檬酸钾(C6H5K3O7•H2O).下列有关对柠檬酸钾的说法正确的是( )
| A. | 该物质每个分子中含有25个原子 | |
| B. | 该物质中碳、氢、钾、氧元素间的质量比是6:7:3:8 | |
| C. | 该物质是由原子直接构成的 | |
| D. | 该物质是由碳、氢、钾、氧四种元素组成的 |
19.对人体中的所需元素,下列四位同学归纳整理完全正确的一组是( )
0 169000 169008 169014 169018 169024 169026 169030 169036 169038 169044 169050 169054 169056 169060 169066 169068 169074 169078 169080 169084 169086 169090 169092 169094 169095 169096 169098 169099 169100 169102 169104 169108 169110 169114 169116 169120 169126 169128 169134 169138 169140 169144 169150 169156 169158 169164 169168 169170 169176 169180 169186 169194 203614
| A. | 小芳认为,人体缺乏下列元素,会得不同疾病.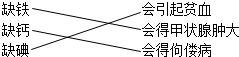 | |
| B. | 小槐搜集资料发现,生活中人们常通过下列途径来补充人体必需的营养元素.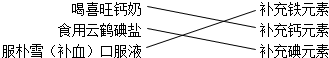 | |
| C. | 小蓉为下列元素各设计了一句广告词来反映其对人体的重要作用. | |
| D. | 小红搜集资料发现,长期或大量摄入铝元素对人体的大脑和神经系统将造成损害,他提出下列建议: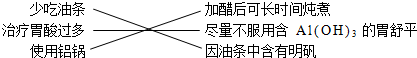 |