题目内容
4.若发现116号元素X,其最外层电子数为6,则下列叙述正确的是( )| A. | X可以形成钠盐,其化学式为NaX | B. | X的最高价氧化物的水化物是强酸 | ||
| C. | X的最高价氧化物的化学式为XO3 | D. | X的单质能与H2直接发生化学反应 |
分析 若发现116号元素X,其元素最外层电子数为6,则该元素位于第VIA族,属于氧族元素,具有氧族元素性质,第七周期稀有气体的原子序数应为118,故116号元素处于第七周期ⅥA族,最高正化合价为+6,金属性比Po强,属于金属元素,据此解答.
解答 解:若发现116号元素X,其元素最外层电子数为6,则该元素位于第VIA族,属于氧族元素,具有氧族元素性质,第七周期稀有气体的原子序数应为118,故116号元素处于第七周期ⅥA族,最高正化合价为+6,金属性比Po强,属于金属元素.
A.该元素是金属元素,不能形成钠盐NaX,故A错误;
B.同主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,其最高价氧化物的水化物应为碱,故B错误;
C.该元素的最高价为+6,则其最高价氧化物的分子式为RO3,故C正确;
D.该元素为金属元素,难与H2直接发生化学反应,故D错误,
故选C.
点评 本题考查原子结构与元素性质关系,难度不大,根据原子序数确定在周期表中的物质是关键,注意掌握同主族元素性质的相似性与递变性.

练习册系列答案
相关题目
18.已知溶液中存在Cr2O72-+H2O?2CrO42-+2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是( )
| A. | 黄色加深 | B. | 橙色加深 | C. | 颜色不变 | D. | 颜色褪去 |
16.分析用石灰水保存鲜蛋的原理如下:
(1)石灰水是碱性物质,能渗入蛋内和酸性物质反应,防止酸败;
(2)石灰水是电解质溶液,促使蛋白质凝聚;
(3)石灰水显弱碱性,有杀菌能力;
(4)石灰水能与鲜蛋呼出的CO2生成CaCO3薄膜,起保护作用.
其中正确的是( )
(1)石灰水是碱性物质,能渗入蛋内和酸性物质反应,防止酸败;
(2)石灰水是电解质溶液,促使蛋白质凝聚;
(3)石灰水显弱碱性,有杀菌能力;
(4)石灰水能与鲜蛋呼出的CO2生成CaCO3薄膜,起保护作用.
其中正确的是( )
| A. | (1)(2) | B. | (1)(2)(3) | C. | (3)(4) | D. | (2)(3)(4) |
3.关于油脂在人体中的生理功能的理解中正确的是( )
| A. | 油脂在人体内的水解、氧化可释放能量,所以油脂可在人体内提供能量 | |
| B. | 为人体合成其他化合物提供原料 | |
| C. | 保持体温,保护内脏器官 | |
| D. | 促进脂溶性维生素A、D、E、K等物质的吸收 |
16.对于A2+3B2=2C反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=4.2 mol•L-1•min-1 |
13.某有机化合物D的结构为 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得: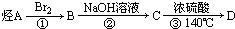 ,下列相关说法中正确的是( )
,下列相关说法中正确的是( )
 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得: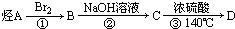 ,下列相关说法中正确的是( )
,下列相关说法中正确的是( )| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
14.柑橘是人们在日常生活中喜爱的水果之一,从柑橘中可提炼出有机物萜二烯,其结构简式为: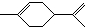 ,下列有关萜二烯的推测不正确的是( )
,下列有关萜二烯的推测不正确的是( )
 ,下列有关萜二烯的推测不正确的是( )
,下列有关萜二烯的推测不正确的是( )| A. | 萜二烯属于芳香族化合物 | B. | 萜二烯难溶于水 | ||
| C. | 萜二烯能发生加聚反应 | D. | 萜二烯能使酸性高锰酸钾溶液褪色 |

