题目内容
2.含氧酸的元数等于羟基氢的个数,氢氧化钠只能中和连在氧上的羟基氢,磷元素有多种含氧酸,如次磷酸(H3PO2)、亚磷酸(H3P03)、磷酸等,它们分别为一元、二 元、三元弱酸或中强酸.(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.
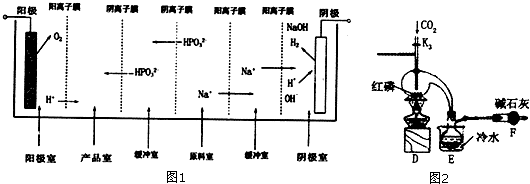
(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PC13 | -112 | 75.5 |
| POCI3 | 2 | 105.3 |
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
分析 (1)由题目信息可知,次磷酸钠(NaH2PO2)和硫酸铜再碱性条件反应生成Na2HPO3,反应中P元素化合价由+1价升高为+3价,P元素发生氧化反应,故Cu元素应发生还原反应,该反应发生镀铜,故反应生成Cu;
(2)阳极室放电生成氧气与氢离子,氢离子通过阳离子交换膜进入产品室,与产品室中HPO32-反应得到H3PO3,氧气可以将H3PO3氧化为H3PO4;阴极室中是水放电生成氢气与氢氧根,钠离子通过阳离子交换膜加入阴极室,故整个过程还有氧气、氢气、氢氧化钠生成;
如果去掉右边两个阳离子膜,导致氢氧化钠中混有Na2HPO3杂质,Na2HPO3为正盐,不与NaOH反应;
(3)利用氯气与红磷反应得到PCl3,由于PCl3遇O2会生成POCl3,PC13遇水会强烈水解生成亚磷酸和HCl,故整个制备过程应在没有氧气、干燥环境下进行,通入二氧化碳排尽装置内空气,PCl3沸点为75.5℃,D中反应得到PCl3蒸汽,再E装置中冷却收集PCl3,未反应的氯气直接排放会污染空气,空气中水蒸气可能进入装置,F装置中碱石灰吸收多余的Cl2,且防止空气中的水蒸气进入烧瓶使PCl3水解;
(4)粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,由于POCl3溶于PC13,形成混合溶液,二者沸点相差较大,可以利用蒸馏法进行分离.
解答 解:(1)由题目信息可知,次磷酸钠(NaH2PO2)和硫酸铜再碱性条件反应生成Na2HPO3,反应中P元素化合价由+1价升高为+3价,P元素发生氧化反应,故Cu元素应发生还原反应,该反应发生镀铜,故反应生成Cu,该反应离子方程式为:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O,
故答案为:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O;
(2)阳极室放电生成氧气与氢离子,氢离子通过阳离子交换膜进入产品室,与产品室中HPO32-反应得到H3PO3,氧气可以将H3PO3氧化为H3PO4,故阳离子膜主要目的是防止:氧气可以将H3PO3氧化为H3PO4,反应方程式为:2H3PO3+O2=2H3PO4,
阴极室中是水放电生成氢气与氢氧根,钠离子通过阳离子交换膜加入阴极室,故整个过程还有氧气、氢气、氢氧化钠生成;
如果去掉右边两个阳离子膜,导致氢氧化钠中混有Na2HPO3杂质,Na2HPO3为正盐,不与NaOH反应,
故答案为:2H3PO3+O2=2H3PO4;氧气、氢气、氢氧化钠;B;
(3)利用氯气与红磷反应得到PCl3,由于PCl3遇O2会生成POCl3,PC13遇水会强烈水解生成亚磷酸和HCl,故整个制备过程应在没有氧气、干燥环境下进行,通入二氧化碳排尽装置内空气,PCl3沸点为75.5℃,D中反应得到PCl3蒸汽,再E装置中冷却收集PCl3,未反应的氯气直接排放会污染空气,空气中水蒸气可能进入装置,F装置中碱石灰吸收多余的Cl2,且防止空气中的水蒸气进入烧瓶使PCl3水解.
①E烧杯内冷水的作用是:冷凝PCl3蒸汽,便于PCl3收集,
②干燥管F的作用是:吸收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解,
③通入干燥CO2的目的是:排尽曲颈瓶中的空气,防止PC13与O3等发生副反应,
故答案为:冷凝PCl3蒸汽,便于PCl3收集;收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解;排尽曲颈瓶中的空气,防止PC13与O3等发生副反应;
(4)粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,由于POCl3溶于PC13,形成混合溶液,二者沸点相差较大,可以利用蒸馏法进行分离,
故答案为:蒸馏.
点评 本题考查化学实验制备、电解原理、化学方程式书写等,是对学生综合能力的考查,注意对题目中信息的应用,难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2悬浊液 ④碘水 ⑤BaCl2溶液.
| A. | ④ | B. | ③⑤ | C. | ②④ | D. | ①③④ |
| A. | 甲酸甲酯 | B. | 淀粉 | C. | 葡萄糖 | D. | 纤维素 |
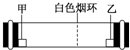 已知气体的摩尔质量越小,扩散速度越快.如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于甲、乙的判断正确的是( )
已知气体的摩尔质量越小,扩散速度越快.如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于甲、乙的判断正确的是( )| A. | 甲是浓氨水,乙是浓硫酸 | B. | 甲是浓盐酸,乙是浓氨水 | ||
| C. | 甲是浓氨水,乙是浓盐酸 | D. | 甲是浓硝酸,乙是浓氨水 |
| A. | Be的氧化物的水化物可能具有两性 | |
| B. | At2为有色固体,HAt不稳定,AgAt感光性很强,既不溶于水也不溶于稀酸 | |
| C. | HClO的酸性一定比H2SO4强 | |
| D. | H2Se是无色、有毒、不如H2S稳定的气体 |
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1L 0.3mol•L-1Na2SO4溶液中,含有Na+和SO42-总数为0.6NA | |
| D. | 常温常压下,32g O2所含氧原子数是2NA |