题目内容
1.过氧化钙可以作为增氧剂,易溶于酸,难溶于水、乙醇等溶剂.用钙盐制取CaO2•8H2O沉淀(该反应是一个放热反应)装置如图1所示.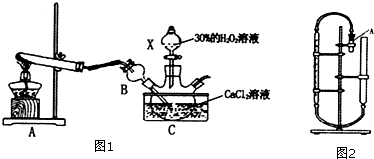
(1)装置A是制取氨气的装置,仪器B的作用是防止倒吸.
(2)制取CaO2•8H2O一般在5℃左右的低温下进行,不可太高,原因是温度过高,过氧化氢容易分解;写出生成CaO2•8H2O的化学方程式CaCl2+H2O2+2NH3+8H2O═CaO2•8H2O↓+2NH4Cl,反应后抽滤且用冰水洗涤,加热至200℃可制得粗品CaO2
(3)CaO2含量测定可以用高锰酸钾滴定法,准确称取一定质量的粗品于250mL锥形瓶中,加人50 mL水和适量盐酸酸化,震荡使其溶解,立即用0.1 mol/L KMnO4标准溶液滴定,写出相关的离子反应方程式(不考虑高锰酸钾与盐酸的反应)5CaO2+2MnO4-+16H+═2Mn2++5Ca2++5O2↑+8H2O
(4)含量测定还可以用间接碘量法、热分解法等,其中热分解法装置如图2所示:先检查装置的气密性.然后在量气管中注人一定量的水,在试管A中加入9.0g样品,连接好装置:充分加热小试管.若产生气体折算到标况下为1120 mL气体,则CaO2纯度为:80%
(5)热分解法误差较大,要减小误差,假设样品分解完全,你认为关键要(任答两点):
①检验装置气密性;②温度要冷却至室温才可读数.
(6)间接碘量法是加入盐酸酸化后再加人过置的碘化钾溶液与过氧化钙反应,然后加 人入淀粉指示剂.用硫代硫酸钠滴定生成的碘单质,写出生成碘单质的化学方程式CaO2+2KI+4HCl=I2+CaCl2+2KCl+2H2O.
分析 (1)A装置制备氨气,氨气极易溶于水,通入C中溶液中,会发生倒吸,可以判断B装置作用;
(2)温度过高,过氧化氢容易分解;结合C中物质可知,过氧化氢、氨气、氯化钙在溶液中反应生成CaO2•8H2O,同时还生成氯化铵;
(3)CaO2酸化得到H2O2与氯化钙,过氧化氢被酸性高锰酸钾氧化生成氧气,还原得到氯化锰;
(4)加热发生反应:2CaO2△_2CaO+O2↑,根据氧气体积计算样品中CaO2的质量,进而计算CaO2的纯度.
(5)利用生成气体的体积计算样品中CaO2的质量,体积测定要准确,装置气密性要好,气体具有热胀冷缩性质,应恢复室温再测定气体的体积;
(6)由题目信息可知,CaO2与KI在酸性条件下反应生成I2,I元素发生氧化反应,CaO2中氧元素发生还原反应生成水,同时生成KCl、氯化钙.
解答 解:(1)A装置制备氨气,氨气极易溶于水,通入C中溶液中,会发生倒吸,可知B装置作用是:防止倒吸,
故答案为:防止倒吸;
(2)由于温度过高,过氧化氢容易分解,CaO2•8H2O一般在5℃左右的低温下进行,不可太高;结合C中物质可知,过氧化氢、氨气、氯化钙在溶液中反应生成CaO2•8H2O,同时还生成氯化铵,反应方程式为:CaCl2+H2O2+2NH3+8H2O═CaO2•8H2O↓+2NH4Cl,
故答案为:温度过高,过氧化氢容易分解;CaCl2+H2O2+2NH3+8H2O═CaO2•8H2O↓+2NH4Cl;
(3)CaO2酸化得到H2O2与氯化钙,过氧化氢被酸性高锰酸钾氧化生成氧气,还原得到氯化锰,反应离子方程式为:5CaO2+2MnO4-+16H+═2Mn2++5Ca2++5O2↑+8H2O;
故答案为:5CaO2+2MnO4-+16H+═2Mn2++5Ca2++5O2↑+8H2O;
(4)加热发生反应:2CaO2△_2CaO+O2↑,生成氧气为1.12L22.4L/mol=0.05mol,故样品中CaO2的质量为0.05mol×2×72g/mol=7.2g,则CaO2的纯度为7.2g9.0g×100%=80%,
故答案为:80%;
(5)利用生成气体的体积计算样品中CaO2的质量,气体体积测定要准确,实验关键要:检验装置气密性,温度要冷却至室温才可读取气体的体积,
故答案为:检验装置气密性;温度要冷却至室温才可读数;
(6)由题目信息可知,CaO2与KI在酸性条件下反应生成I2,I元素发生氧化反应,CaO2中氧元素发生还原反应生成水,同时生成KCl、氯化钙,反应方程式为:CaO2+2KI+4HCl=I2+CaCl2+2KCl+2H2O,
故答案为:CaO2+2KI+4HCl=I2+CaCl2+2KCl+2H2O.
点评 本题考查实验制备,涉及方程式的书写、物质含量测定、对操作与装置的分析评价,明确实验原理是解答关键,充分考查了学生的分析理解能力、知识迁移运用能力,难度中等.

| A. | 含0.1NA个 H的H2O中,O的质量为0.8g | |
| B. | 0.012kg C所含的C数为NA | |
| C. | 98g H2SO4溶于2L水,取其中500mL,溶液中c(H+)为1mol/L | |
| D. | 通常状况下,1mol H2O的体积小于22.4L |
| A. | 所含元素化合价升高的物质是还原剂 | |
| B. | 氧化剂失去电子,所含元素的化合价升高 | |
| C. | 作氧化剂的物质不能作还原剂 | |
| D. | 化合价降低,失去电子的物质是还原剂 |
| A. | K、Na、Al | B. | Na、K、Zn、Fe | C. | Zn、Fe、Cu、Ag | D. | Mg、Al、Zn、Fe |
| A. | 该物质每个分子中含有25个原子 | |
| B. | 该物质中碳、氢、钾、氧元素间的质量比是6:7:3:8 | |
| C. | 该物质是由原子直接构成的 | |
| D. | 该物质是由碳、氢、钾、氧四种元素组成的 |
| A. |  乐山大佛 | B. |  开封铁塔 | ||
| C. |  故宫前的铜狮子 | D. |  华岩寺露天金佛 |
| A. | 由KAt的水溶液制备砹的化学方程式为2KAt+Cl2═2KCl+At2 | |
| B. | AgAt是一种难溶于水的化合物 | |
| C. | 相同条件下HAt比HI稳定 | |
| D. | At元素位于第六周期 |
| A. | FeS | B. | Al2S3 | C. | FeCl2 | D. | Fe3O4 |