7.氯苯是重要的有机化工产品,是燃料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl
+HCl
回答下列问题:
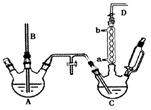
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥笨的反应器C中(内有相当于笨量1%的铁屑作催化剂).
加热维持反应温度在40-60℃为宜,温度过高回生成过多的二氯苯.
①对C加热的方法时c(填序号).
a.酒精灯加热b.油浴加热c.水浴加热
②D出口的气体成份有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗,碱洗以及食盐干燥,才能蒸馏.
①碱洗之前要水洗的目的是洗去一部分无机物,同时为了减少碱的用量,节约成本.
②写出用10%氢氧化钠溶液碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O等.
(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一U型管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
则1t苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$t(只要求列式)

 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl
+HCl回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥笨的反应器C中(内有相当于笨量1%的铁屑作催化剂).
加热维持反应温度在40-60℃为宜,温度过高回生成过多的二氯苯.
①对C加热的方法时c(填序号).
a.酒精灯加热b.油浴加热c.水浴加热
②D出口的气体成份有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗,碱洗以及食盐干燥,才能蒸馏.
①碱洗之前要水洗的目的是洗去一部分无机物,同时为了减少碱的用量,节约成本.
②写出用10%氢氧化钠溶液碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O等.
(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一U型管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
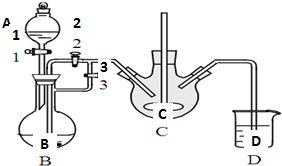
4.四氯化锡(SnCl4)是一种重要的化工产品.某兴趣小组拟制备四氯化锡.
I.【查阅资料】
Ⅱ.【制备产品】
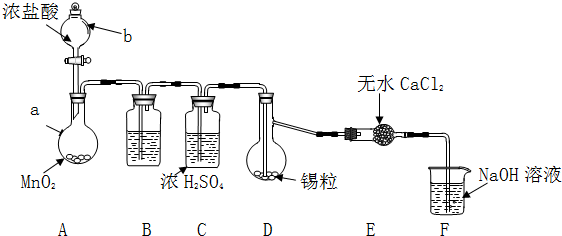
实验装置如图所示(省略夹持和加热装置)
实验步骤:
(1)检查装置气密性后,按图示加入试剂.仪器b的名称是分液漏斗,其中无水CaCl2的作用是吸收水蒸气,防止进入D中使SnCl4水解,B中的试剂是C(选填下列字母编号).
A.Na2CO3 溶液 B.NaOH溶液 C.饱和NaCl溶液 D.NaHCO3溶液
(2)先向A中烧瓶内加入盐酸并加热a,当整个装置充满黄绿色气体后(填实验现象),再加热熔化锡粒,反应完后,停止加热.
(3)待反应结束后,经过滤(填写操作名称)、洗涤、干燥,可回收利用装置A中未反应完的MnO2.
Ⅲ.[探究与反思]
(1)装置F中吸收Cl2发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(2)实验在D中得到的产品很少,经分析装置设计有缺陷,应在D和E之间补充连有冷凝管的集气瓶(填装置名称).
(3)为验证产品中是否含有SnCl2,该小组设计了以下实验方案:(所需试剂从稀HNO3、稀HCl、FeCl3溶液、FeCl2溶液、KSCN溶液、蒸馏水中选择)
取适量0.5mL产品溶入20mL蒸馏水中,加入适量稀HCl和KSCN溶液,再滴入几滴FeCl3溶液,若不出现红色(填实验现象),则含有SnCl2,否则无SnCl2.
I.【查阅资料】
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
实验装置如图所示(省略夹持和加热装置)

实验步骤:
(1)检查装置气密性后,按图示加入试剂.仪器b的名称是分液漏斗,其中无水CaCl2的作用是吸收水蒸气,防止进入D中使SnCl4水解,B中的试剂是C(选填下列字母编号).
A.Na2CO3 溶液 B.NaOH溶液 C.饱和NaCl溶液 D.NaHCO3溶液
(2)先向A中烧瓶内加入盐酸并加热a,当整个装置充满黄绿色气体后(填实验现象),再加热熔化锡粒,反应完后,停止加热.
(3)待反应结束后,经过滤(填写操作名称)、洗涤、干燥,可回收利用装置A中未反应完的MnO2.
Ⅲ.[探究与反思]
(1)装置F中吸收Cl2发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(2)实验在D中得到的产品很少,经分析装置设计有缺陷,应在D和E之间补充连有冷凝管的集气瓶(填装置名称).
(3)为验证产品中是否含有SnCl2,该小组设计了以下实验方案:(所需试剂从稀HNO3、稀HCl、FeCl3溶液、FeCl2溶液、KSCN溶液、蒸馏水中选择)
取适量0.5mL产品溶入20mL蒸馏水中,加入适量稀HCl和KSCN溶液,再滴入几滴FeCl3溶液,若不出现红色(填实验现象),则含有SnCl2,否则无SnCl2.
3. 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL的水洗涤.有机层继续用10mL 10% Na2CO3洗涤至中性,再用10mL的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯滤入50mL烧瓶中,常压蒸馏,收集125~127℃的馏分,得11.6g乙酸正丁酯
请回答有关问题.
(1)冷水应该从冷凝管a(填a或b)管口通入.
(2)步骤①中不断从分水器下部分出生成的水的目的是使用分水器分离出水,使平衡正向移动,提高反应产率,步骤①中判断反应终点的依据是分水器中的水层量不再增加.
(3)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(4)下列关于分液漏斗的使用叙述正确的是D
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是80%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL的水洗涤.有机层继续用10mL 10% Na2CO3洗涤至中性,再用10mL的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯滤入50mL烧瓶中,常压蒸馏,收集125~127℃的馏分,得11.6g乙酸正丁酯
请回答有关问题.
(1)冷水应该从冷凝管a(填a或b)管口通入.
(2)步骤①中不断从分水器下部分出生成的水的目的是使用分水器分离出水,使平衡正向移动,提高反应产率,步骤①中判断反应终点的依据是分水器中的水层量不再增加.
(3)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(4)下列关于分液漏斗的使用叙述正确的是D
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是80%.
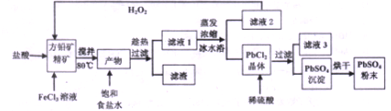
2.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
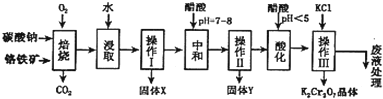
已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅰ的名称是过滤,固体X中主要含有Fe2O3、MgO(填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为Al(OH)3(写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+?Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害.电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀.
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3):n(H2)=1:1)
6Fe+1Cr2O72-+2H++17H2O═6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10-32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于5.6.(已知lg2=0.3)

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅰ的名称是过滤,固体X中主要含有Fe2O3、MgO(填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为Al(OH)3(写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+?Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3):n(H2)=1:1)
6Fe+1Cr2O72-+2H++17H2O═6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10-32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于5.6.(已知lg2=0.3)
1.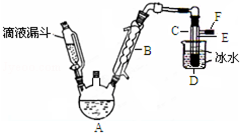 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
表.乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是abc(选填序号).
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发 d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式CH3CH2OH+NaBr+H2SO4$\stackrel{△}{→}$NaHSO4+CH3CH2Br+H2O.
(3)仪器B的名称球形冷凝管,冷却水应从B的下(填“上”或“下”)口流进.
(4)反应生成的溴乙烷应在C中(填“A”或“C”中).
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列b(选填序号)溶液来洗涤产品.
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有分液漏斗、烧杯.
 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见表:表.乙醇、溴乙烷、溴有关参数
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发 d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式CH3CH2OH+NaBr+H2SO4$\stackrel{△}{→}$NaHSO4+CH3CH2Br+H2O.
(3)仪器B的名称球形冷凝管,冷却水应从B的下(填“上”或“下”)口流进.
(4)反应生成的溴乙烷应在C中(填“A”或“C”中).
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列b(选填序号)溶液来洗涤产品.
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有分液漏斗、烧杯.
18.下列关于胶体的认识正确的是( )
| A. | 鸡蛋清在水中形成的分散系是一种液溶胶,往其中加入饱和(NH4)2SO4溶液会生成白色沉淀 | |
| B. | 可用丁达尔效应来区分胶体和溶液 | |
| C. | 胶体中存在布朗运动,其他分散系中不存在布朗运动 | |
| D. | 某纯净纳米材料其粒子直径从几纳米到几十纳米,该纳米材料属于胶体 |
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
0 168980 168988 168994 168998 169004 169006 169010 169016 169018 169024 169030 169034 169036 169040 169046 169048 169054 169058 169060 169064 169066 169070 169072 169074 169075 169076 169078 169079 169080 169082 169084 169088 169090 169094 169096 169100 169106 169108 169114 169118 169120 169124 169130 169136 169138 169144 169148 169150 169156 169160 169166 169174 203614
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: