题目内容
3. 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL的水洗涤.有机层继续用10mL 10% Na2CO3洗涤至中性,再用10mL的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯滤入50mL烧瓶中,常压蒸馏,收集125~127℃的馏分,得11.6g乙酸正丁酯
请回答有关问题.
(1)冷水应该从冷凝管a(填a或b)管口通入.
(2)步骤①中不断从分水器下部分出生成的水的目的是使用分水器分离出水,使平衡正向移动,提高反应产率,步骤①中判断反应终点的依据是分水器中的水层量不再增加.
(3)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(4)下列关于分液漏斗的使用叙述正确的是D
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是80%.
分析 (1)冷凝管中冷凝水应从下口进上口出;
(2)分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;分水器中的水层量不再增加,说明反应结束;
(3)乙酸与水互溶,正丁醇溶于水,先用水洗涤,可以除去乙酸及少量的正丁醇;用饱和Na2CO3溶液洗涤有机层,除去产品中含有的乙酸等杂质;
(4)A.旋塞与玻璃塞处均检验是否漏水;
B.分液漏斗中液体的总体积不得超过其容积的一半;
C.应使分液漏斗口朝下,使分液漏斗长颈朝上;
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,平衡分液漏斗内气压,便于液体流向;
(5)温差过大,容易导致冷凝管炸裂;
(6)先根据反应方程式计算酸和醇哪个过量,按照量少的计算理论上酯的量,实际上酯的量与理论值之比即为酯的产率.
解答 解:(1)采取逆流原理,冷凝管中冷凝水应从下口进上口出,
故答案为:a;
(2)反应生成酯与水,属于可逆反应,使用分水器分离出水,使平衡正向移动,提高反应产率;分水器中的水层量不再增加,说明反应到达终点,
故答案为:使用分水器分离出水,使平衡正向移动,提高反应产率;分水器中的水层量不再增加;
(3)乙酸与水互溶,正丁醇溶于水,先用水洗涤,可以除去乙酸及少量的正丁醇;用饱和Na2CO3溶液洗涤有机层,除去产品中含有的乙酸等杂质,
故答案为:除去乙酸及少量的正丁醇;除去产品中含有的乙酸等杂质;
(4)A.旋塞与玻璃塞处均检验是否漏水,故A错误;
B.分液漏斗中液体的总体积不得超过其容积的一半,故B错误;
C.应使分液漏斗口朝下,使分液漏斗长颈朝上,便于放气降低分液漏斗内气压,故C错误;
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,平衡分液漏斗内气压,便于液体流向,故D正确,
故答案为:D;
(5)沸点大于140℃的有机化合物的蒸馏,用冷凝水冷凝,温差过大,容易导致冷凝管炸裂,
故答案为:防止因温差过大,冷凝管炸裂;
(6)13.5mL正丁醇的质量为13.5mL×0.80g/mL=10.8g,7.2mL冰醋酸的质量为7.2mL×1.045g/mL=7.524g,
设理论上10.8g正丁醇完全反应需乙酸的质量是y,则:
CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
60g 74g
y 10.8g
y=$\frac{10.8g×60g}{74g}$=8.76g>7.524,所以乙酸不足,按照乙酸的量计算乙酸正丁醇酯的理论质量,
设乙酸正丁醇酯的理论质量为x,则:
CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
60g 116g
7.524g x
所以x=$\frac{7.524g×116g}{60g}$=14.5464g
则乙酸正丁酯的产率为$\frac{11.6g}{14.5464g}$×100%≈80%,
故答案为:80%.
点评 本题考查有机物物质制备的实验,涉及对反应原理的理解应用、对操作的分析评价、物质的分离提纯、产率计算等,注意根据乙酸乙酯的制备进行知识迁移应用,较好的考查学生的分析能力、数据处理能力,难度中等.

| A. | 加入食盐水 | B. | 加入硫酸铜溶液 | C. | 煮沸 | D. | 加入浓硝酸 |
| A. | 酸性强弱:HClO3>H2SO3>H3PO4 | B. | 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性HCl>H2S>PH3 | D. | 氧化性Na+>Mg2+>Al3+ |
 (1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+$\frac{3}{2}$O2(g);△H=+765.2kJ•mol-1,请在坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注.
(1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+$\frac{3}{2}$O2(g);△H=+765.2kJ•mol-1,请在坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注.
 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
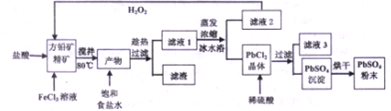
 ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称:
”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称: