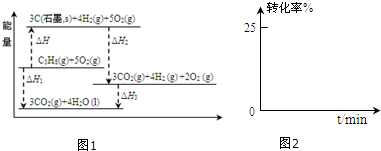5.下列哪一种方法能证明一种无色液体是纯净的水( )
| A. | 测得这种液体的pH值等于7 | |
| B. | 在1.01×105Pa的压强下测得其沸点为373K | |
| C. | 电解这种液体,在阴极得到的气体体积为阳极气体体积的两倍 | |
| D. | 测得该液体不导电 |
4.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol氢氧化铜后恰好恢复到电解前的浓度和pH.则电解过程中转移电子的物质的量为( )
| A. | 0.4mol | B. | 0.3 mol | C. | 0.2mol | D. | 0.1 mol |
3.芜湖铁画是中国工艺美术百花园中的一朵奇葩,至今已有三百多年的历史.下列关于铁画生锈与防护的描述中不正确的是( )
| A. | 悬挂在干燥的环境中 | B. | 经常清扫表面的灰尘可以防止生锈 | ||
| C. | 表面涂漆防止生锈 | D. | 生锈时主要生成四氧化三铁 |
2.每年6月5日是世界环境日,今年我国环保总局确定的主题是“人人参与,创建绿色家园”.下列措施不符合这一主题的是( )
| A. | 推广垃圾分类存放,分类回收,分类处理 | |
| B. | 改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的做法,采用先开采和综合利用煤层气,然后再采煤的方法 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 将工厂的烟囱造高,以减少工厂周围的大气污染 |
1.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
回答下列问题:
①3~4min和7~9min时段,反应处于平衡状态.
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强,平衡向正方向移动.
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①3~4min和7~9min时段,反应处于平衡状态.
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强,平衡向正方向移动.
19.HPE是合成除草剂的重要中间体,其结构简式如图所示.下列有关HPE的说法正确的是( )


| A. | 含1mol HPE的溶液最多可以和2molNaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | 1molHPE能与4molH2发生加成反应 | |
| D. | HPE分子中最多有12个原子共平面 |
18.下列离子方程式书写正确的是( )
| A. | 用铜电极电解氯化钙溶液:2 Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 向碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2 HCO3-+2OH-→CaCO3↓+2H2O+CO32- | |
| C. | 在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| D. | 向偏铝酸钠溶液中加入足量的NaHSO4溶液:AlO2-+H++H2O═Al(OH)3↓ |
17.下列关于NH3或氨水的实验能达到目的是B(填编号)
| 编号 | A | B | C | D |
实验 装置 |  | 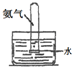 | 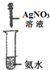 | 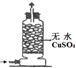 |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |
16.化学反应的能量变化、速率、限度是化学研究的重要内容.
(1)有关研究需要得到C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行.
设计如图1可计算得到:
①△H>0(填>、<或=)
②△H=△H1-△H2-△H3.(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料.它们的一些性质如下:
工业制备甲酸原理:HCOOCH3(l)+H2O(l)$\stackrel{H+}{?}$ HCOOH(l)+CH3OH(l),反应吸热,但焓变的值很小.常温常压下,水解反应速率和平衡常数都较小.
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响.甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移.甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移.某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%.
②预测HCOOCH3转化率随时间的变化趋势并画图2表示.
③该反应在温度T1下的平衡常数K=0.048.(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景.写出该燃料电池的电极反应式:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
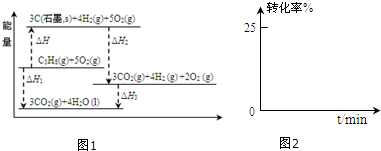
0 168927 168935 168941 168945 168951 168953 168957 168963 168965 168971 168977 168981 168983 168987 168993 168995 169001 169005 169007 169011 169013 169017 169019 169021 169022 169023 169025 169026 169027 169029 169031 169035 169037 169041 169043 169047 169053 169055 169061 169065 169067 169071 169077 169083 169085 169091 169095 169097 169103 169107 169113 169121 203614
(1)有关研究需要得到C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行.
设计如图1可计算得到:
①△H>0(填>、<或=)
②△H=△H1-△H2-△H3.(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料.它们的一些性质如下:
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响.甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移.甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移.某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%.
②预测HCOOCH3转化率随时间的变化趋势并画图2表示.
③该反应在温度T1下的平衡常数K=0.048.(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景.写出该燃料电池的电极反应式:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.