题目内容
16.化学反应的能量变化、速率、限度是化学研究的重要内容.(1)有关研究需要得到C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行.
设计如图1可计算得到:
①△H>0(填>、<或=)
②△H=△H1-△H2-△H3.(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料.它们的一些性质如下:
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响.甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移.甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移.某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%.
②预测HCOOCH3转化率随时间的变化趋势并画图2表示.
③该反应在温度T1下的平衡常数K=0.048.(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景.写出该燃料电池的电极反应式:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
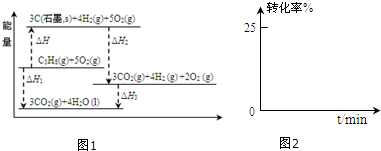
分析 (1)由图象可知,反应物总能量小于生成物总能量,则正反应为吸热反应,结合盖斯定律计算反应热;
(2)①加入甲醇,增大反应接触面积,加快反应速率,加入甲酸,甲酸能电离出H+作催化剂能加快反应速率,甲醇、甲酸都是生成物,增大生成物浓度,平衡逆向移动;
②反应开始时速率较慢,生成甲酸电离出H+作催化剂能加快反应速率,随着反应的进行,浓度逐渐减小,反应速率逐渐减慢,以此预测HCOOCH3转化率随时间的变化趋势;
③测得平衡是HCOOCH3的转化率为25%,结合酯水比为1:2以及K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$计算;
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景,酸性条件下形成原电池反应时,负极发生氧化反应,HCOOH被氧化生成二氧化碳,正极发生还原反应,氧气被还原生成水.
解答 解:(1)①由图象可知,反应物总能量小于生成物总能量,则正反应为吸热反应,即△H>0,故答案为:>;
②由图象可知|△H|+|△H1|=|△H2|+|△H3|,因△H1、△H2、△H3都小于0,则△H=△H1-△H2-△H3,故答案为:△H1-△H2-△H3;
(2)①加入甲醇,增大反应接触面积,加快反应速率,加入甲酸,甲酸能电离出H+作催化剂能加快反应速率,甲醇、甲酸都是生成物,增大生成物浓度,平衡逆向移动,即甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移;甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移,
故答案为:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移;甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移;
②反应开始时速率较慢,生成甲酸电离出H+作催化剂能加快反应速率,随着反应的进行,浓度逐渐减小,反应速率逐渐减慢,以此预测HCOOCH3转化率随时间的变化趋势为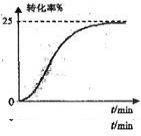 ,故答案为:
,故答案为: ;
;
③测得平衡是HCOOCH3的转化率为25%,结合酯水比为1:2,设HCOOCH3为1mol,则水为2mol,平衡生成HCOOH、CH3OH都为0.25mol,剩余HCOOCH30.75mol,水1.75mol,
K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$=$\frac{0.25×0.25}{0.75×1.75}$=0.048,
故答案为:0.048;
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景,酸性条件下形成原电池反应时,负极发生氧化反应,HCOOH被氧化生成二氧化碳,电极方程式为2HCOOH-4e-=2CO2 ↑+4H+,正极发生还原反应,氧气被还原生成水,电极方程式为O2 +4e-+4H+=2H2O,
故答案为:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
点评 本题考查较为综合,为高考常见题型,侧重于考生对反应热、化学平衡其影响因素以及化学电源的理解和应用的考查,对化学平衡常数简单计算的掌握,注重考查学生知识迁移、读图及表达能力,难度中等.

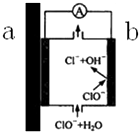 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )| A. | 如果是镀锌管,则a端为Zn,是负极,产生Zn2+,不但会造成管道锈蚀,Zn2+溶于自来水也对人体有害 | |
| B. | b端发生的电极反应为:ClO-+H2O-2e-═Cl-+2OH- | |
| C. | 由于该原电池原理的存在,一定程度上减弱了自来水中余氯的杀菌消毒功能 | |
| D. | 从自来水厂到用户,经过该类管道的长期接触,自来水的酸碱性发生了变化 |
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 | |
| D. | 分别向等体积的上述溶液中加入100 mL,水,溶液的pH:③>④>①>② |
| A. | 在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1molSO2转移电子数为5.5NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 50g46%的乙醇水溶液中,含氢原子总数目为3NA |
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①3~4min和7~9min时段,反应处于平衡状态.
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强,平衡向正方向移动.
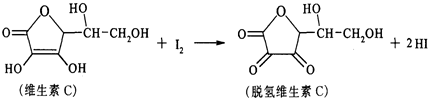
| A. | 上述反应为 取代反应 | |
| B. | 维生素C在酸性条件下水解只得到1种产物 | |
| C. | 滴定时可用淀粉溶液作指示剂 | |
| D. | 维生素C的分子式为C6H10O6 |
①熔沸点较高 ②能溶于水 ③水溶液能导电 ④有较深的颜色 ⑤熔融状态不导电.
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
 已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:
已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空: