15.丙烷是一种重要的烷烃,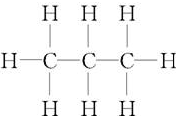 表示其( )
表示其( )
 表示其( )
表示其( )| A. | 结构简式 | B. | 结构式 | C. | 电子式 | D. | 分子式 |
14.设v(正)和v(逆)分别表示可逆反应的正反应速率和逆反应速率.在一定温度下可逆反应N2+3H2$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3达到平衡时( )
| A. | V(逆)>V(正) | B. | V(逆)<V(正) | ||
| C. | V(逆)>V(正),正逆反应停止 | D. | V(逆)=V(正),正逆反应仍进行 |
13.在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g)?3C(g),只有反应到达平衡时才具有的性质是( )
| A. | 各物质的浓度之比为2:3:3 | |
| B. | ν(A)、ν(B)、ν(C) 之比为2:3:3 | |
| C. | A、B、C三种物质的浓度不随时间变化而变化 | |
| D. | 混合物各物质的量浓度相等 |
10.在恒容密闭容器中,一定温度下,可逆反应A(s)+3B(g)?2C(g)+D(g)达到平衡状态的标志是( )
| A. | 混合气体的密度不再改变的状态 | |
| B. | 单位时间生成2n mol C,同时生成n mol D | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | A、B、C、D的分子数之比为1:3:2:1 |
7.下表是A、B、C、D四种有机物的有关信息.
请回答下列问题.
(1)写出有机物C的结构简式HCOOH.
(2)写出B→D的化学反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(3)写出A与NH3在一定条件下反应生成丙烯酰胺的化学方程式,并指出反应类型:CH2=CHCOOH+NH3→CH2=CHCOONH2+H2O,反应类型取代反应.
(4)丙烯酰胺有多种同分异构体,试写出分子中同时含有醛基和碳碳双键的3种同分异构体的结构简式CH2=CHNHCHO、CH2=C(NH2)CHO、CH(NH2)=CHCHO.
| A | 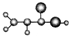 ①由C、H、O三种元素组成 ②球棍模型为: ③能与NH3在一定条件下反应生成丙烯酰胺CH2=CHCONH2 ④相对分子质量为72 |
| B | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与A反应生成相对分子质量为100的酯 |
| C | ①相对分子质量与B相同 ②能被新制的氢氧化铜悬浊液氧化 ③能与NaHCO3溶液反应放出CO2气体 |
| D | ①能使溴的四氯化碳溶液褪色 ②能与水在一定条件下反应生成B |
(1)写出有机物C的结构简式HCOOH.
(2)写出B→D的化学反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(3)写出A与NH3在一定条件下反应生成丙烯酰胺的化学方程式,并指出反应类型:CH2=CHCOOH+NH3→CH2=CHCOONH2+H2O,反应类型取代反应.
(4)丙烯酰胺有多种同分异构体,试写出分子中同时含有醛基和碳碳双键的3种同分异构体的结构简式CH2=CHNHCHO、CH2=C(NH2)CHO、CH(NH2)=CHCHO.
6.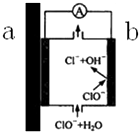 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
0 168920 168928 168934 168938 168944 168946 168950 168956 168958 168964 168970 168974 168976 168980 168986 168988 168994 168998 169000 169004 169006 169010 169012 169014 169015 169016 169018 169019 169020 169022 169024 169028 169030 169034 169036 169040 169046 169048 169054 169058 169060 169064 169070 169076 169078 169084 169088 169090 169096 169100 169106 169114 203614
 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )| A. | 如果是镀锌管,则a端为Zn,是负极,产生Zn2+,不但会造成管道锈蚀,Zn2+溶于自来水也对人体有害 | |
| B. | b端发生的电极反应为:ClO-+H2O-2e-═Cl-+2OH- | |
| C. | 由于该原电池原理的存在,一定程度上减弱了自来水中余氯的杀菌消毒功能 | |
| D. | 从自来水厂到用户,经过该类管道的长期接触,自来水的酸碱性发生了变化 |
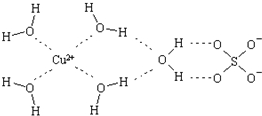 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.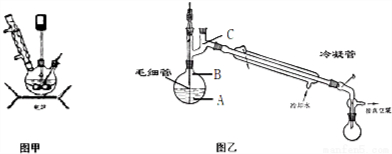 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.