13.X、Y、Z均为短周期元索,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 单质活泼性:X>Y>Z | ||
| C. | 原子序数:X>Y>Z | D. | 离子半径:X2->Y+>Z- |
12.海带中碘元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
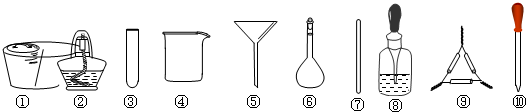

| A. | 将干海带剪碎后灼烧灰化,选用①、②和⑨ | |
| B. | 将海带灰加入蒸馏水搅拌煮沸,选用④、⑥和⑦ | |
| C. | 过滤得到的滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的I-,选用③、⑧和⑩ |
11.我国明代宋应星所著《天工开物》中有关于“升炼倭铅”的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,封裹泥固,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷定毁罐取出,…,即倭铅也,…,以其似铅而性猛,故名之曰倭”,下列对于这段话中描述的理解错误的是( )
| A. | 我国历史上铅的使用早于锌 | B. | 锌和铅有相似性但锌更活泼 | ||
| C. | 所得产品中混有煤炭 | D. | 属于热还原法冶炼金属 |
10.往100mL氢离子浓度为1mol•L-1的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况).则反应前的混合液中含硫酸的物质的量为( )
| A. | 0.01mol | B. | 0.02 mol | C. | 0.03 mol | D. | 0.04 mol |
9.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 锂(Li)的密度比钠小,锂的熔沸点也比钠低 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
8.浓硫酸在与含有水分的蔗糖作用过程中没有显示的性质是( )
| A. | 强氧化性 | B. | 脱水性 | C. | 酸性 | D. | 吸水性 |
7.近期我国合成多种元素的新同位素,其中一种是${\;}_{72}^{185}$Hf(铪),它的中子数和电子数之差是( )
| A. | 41 | B. | 72 | C. | 113 | D. | 185 |
6.化学为人类基本的生存需要、进而追求生活乃至生命质量的提升提供了重要的保障.但某些人的贪得无厌和对化学原理的滥用败坏了化学学科声誉,我们每个人都应该避免成为这样的人.下列科学史上的重要发现与发明,从原理上看与化学学科没有直接相关性的是( )
| A. | 1774年舍勒最早制得氯气,1820年前后漂白粉用于饮用水消毒 | |
| B. | 1869年门捷列夫发现元素周期律,使元素的性质更有规律可循 | |
| C. | 1902年哈伯开始对合成氨反应进行研究,工业化后提高了粮食产量 | |
| D. | 1942年费米进行了235U原子核裂变试验,从而开创原子能利用时代 |
4.下表给出14-17号元素的一些性质,请回答:
(1)它们所形成的氢化物中稳定性最差的是SiH4,还原性最差的是HCl.
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
0 168887 168895 168901 168905 168911 168913 168917 168923 168925 168931 168937 168941 168943 168947 168953 168955 168961 168965 168967 168971 168973 168977 168979 168981 168982 168983 168985 168986 168987 168989 168991 168995 168997 169001 169003 169007 169013 169015 169021 169025 169027 169031 169037 169043 169045 169051 169055 169057 169063 169067 169073 169081 203614
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.