12.可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测正确的是( )
| A. | “类钫”属过渡元素,具有放射性 | B. | “类钫”可与水剧烈反应 | ||
| C. | “类钫”单质的密度小于1g/cm3 | D. | “类钫”单质有较高熔点 |
11.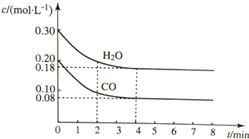 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
(1)则0~4min内反应速率v(CO)为0.03mol/(L•min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
1000℃时物质浓度的变化
①c1数值>0.08mol/L(填“<”“>”或“=”);
②表中5~6min之间数值发生变化,可能的原因是a(填字母).
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度.
 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.(1)则0~4min内反应速率v(CO)为0.03mol/(L•min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
1000℃时物质浓度的变化
| t/min | c(CO)/(mol•L-1) | c(H2O)/(mol•L-1) | c(CO2)/(mol•L-1) | c(H2)/(mol•L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 1 | 0.138 | 0.238 | 0.062 | 0.062 |
| 2 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.084 |
| 6 | 0.096 | 0.266 | 0.104 | 0.104 |
②表中5~6min之间数值发生变化,可能的原因是a(填字母).
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度.
10.在容积固定的密闭容器中,发生反应CO2(g)+H2(g)?CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)该反应为吸热反应(填“吸热”或“放热”.)
(3)能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)=c(CO)
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)该反应为吸热反应(填“吸热”或“放热”.)
(3)能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)=c(CO)
9.向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+3OH-?Cr(OH)3(灰蓝色)?CrO2-(绿色)+H++H2O.将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液.a、b试管中溶液颜色最终分别为( )
| 选项 | A | B | C | D |
| a试管 | 紫色 | 蓝灰色 | 绿色 | 蓝灰色 |
| b试管 | 绿色 | 绿色 | 紫色 | 紫色 |
| A. | A | B. | B | C. | C | D. | D |
8.已知反应A?2B,A、B的浓度变化如图所示,下列反应速率正确的是( )

| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
7.下列说法中正确的是( )
| A. | 分子组成中相差一个或几个CH2 原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构不同的有机物不一定是同分异构体 | |
| D. | 互为同系物的有机物其分子结构必然相似 |
6.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
4.如图所示装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )


| A. | 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色 | |
| B. | 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 | |
| C. | 若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红 | |
| D. | 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
3.在一密闭容器中进行反应2SO2+O2?2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为2mol•L-1、1mol•L-1、2mol•L-1.当反应达到平衡时,容器内各物质的浓度可能为( )
0 168746 168754 168760 168764 168770 168772 168776 168782 168784 168790 168796 168800 168802 168806 168812 168814 168820 168824 168826 168830 168832 168836 168838 168840 168841 168842 168844 168845 168846 168848 168850 168854 168856 168860 168862 168866 168872 168874 168880 168884 168886 168890 168896 168902 168904 168910 168914 168916 168922 168926 168932 168940 203614
| A. | SO2为4 mol•L-1、O2为2 mol•L-1 | B. | SO3为4 mol•L-1 | ||
| C. | SO2为2.5 mol•L-1 | D. | SO2、SO3为1.5 mol•L-1 |