11.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:
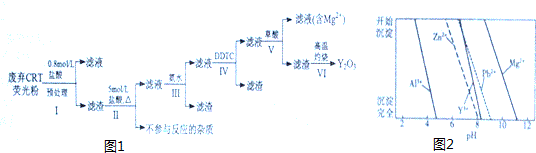
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示;
②不同离子沉淀的pH如图2所示.
(1)步骤Ⅰ中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量.
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤Ⅴ中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-25)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.

已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表所示;
②不同离子沉淀的pH如图2所示.
| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤Ⅴ中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-25)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
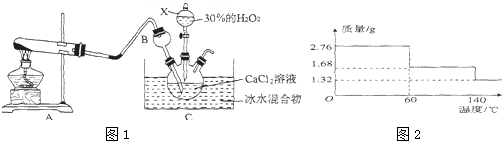
10.氢氧化锂(LiAlH4)既是金属储氢材料又是有机合成中常用的试剂,溶于适量的水可得到无色溶液:LiAlH4+2H2O═LiAlO2+4H2↑,在125℃分解为LiH、H2和Al.下列说法不正确的是( )
| A. | LiAlH4中H元素的化合价为-1 | |
| B. | LiAlH4L、iAlO2、LiH均是离子化合物 | |
| C. | 1mol LiAlH4在125℃完全分解,转移4mol电子 | |
| D. | 0.5 mol LiAlH4与水充分反应后产生44.8L H2 |
9.一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
8.关于键长、键能和键角,下列说法错误的是( )
| A. | 键角是确定多原子分子立体结构(分子形状)的重要参数 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 共价键的键长越长,键能则越小,共价化合物也就越稳定 | |
| D. | 同种原子间形成的共价键键长:叁键<双键<单键 |
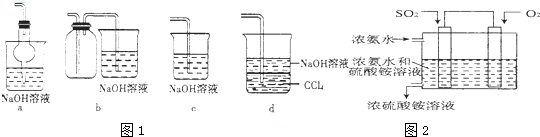
7.关于氨水、氯水、双氧水和王水的说法,正确的是( )
| A. | 氨水能导电,说明氨气是电解质 | |
| B. | 新制的氯水中存在3 种分子,4 种离子 | |
| C. | 双氧水被称为“绿色氧化剂”其还原产物为O2 | |
| D. | 王水是浓盐酸和浓硝酸按体积比1:3 配成 |
6.下列“假说“在化学科学发展过程中曾经起到一定的作用,至今仍公认为化学原理的是( )
0 168528 168536 168542 168546 168552 168554 168558 168564 168566 168572 168578 168582 168584 168588 168594 168596 168602 168606 168608 168612 168614 168618 168620 168622 168623 168624 168626 168627 168628 168630 168632 168636 168638 168642 168644 168648 168654 168656 168662 168666 168668 168672 168678 168684 168686 168692 168696 168698 168704 168708 168714 168722 203614
| A. | 1803 年道尔顿提出的“元素的原子以其原子质量为特征” | |
| B. | 1808 年盖•吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子” | |
| C. | 1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“ | |
| D. | 1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子” |
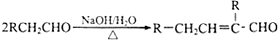 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下: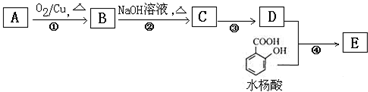
 ;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键;
;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键; 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、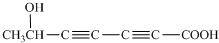 ;
; :
: 叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成. .
.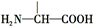
 +2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.
+2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.