题目内容
5.铜、铝、硫及其它们的化合物应用广泛,如Cu可用作催化剂、制作印刷电路铜板等.Ⅰ.铜的冶炼:工业上以辉铜矿为原料,采用火法熔炼工艺生产铜.
火法炼铜的方程式为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 ,该工艺的中间过程会发生反应2Cu20+辉铜矿$\frac{\underline{\;高温\;}}{\;}$6Cu+m↑,若反应每生成5.6L(标准状况下)m气体.则转移电子的物质的量为1.5mol
Ⅱ.粗铜精炼:利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是DE.
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu一2e-=Cu2+
D.电解后.电解槽底部会形成含少量Ag、Pt等金属的阳极泥
E.整个过程溶液中的Cu2+浓度减少
Ⅲ.铜及其化合物的性质探究:
将洁净的铜丝放在火焰上加热.并趁热插入到乙醇中,铜丝表面的现象为铜丝表面先变黑,后变为红色,发生的反应为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CuO+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O.
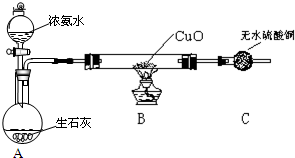
Ⅳ.无水氯化铝是一种重要的化工原料.利用明矾石:K2SO4•A12(SO4)3•2A1203•6H20]制备无水氯化铝的流程如下:

(1)验证焙烧炉产生的气体含有SO2的方法是将气体通入品红中,品红褪色,加热后又恢复红色,证明有SO2.
(2)吸收焙烧炉中产生的S02,下列装置如图1合理的是ad(填代号).

(3)氯化炉中发生反应的化学反应方程式为3C+Al2O3+3Cl2$\frac{\underline{\;高温\;}}{\;}$3CO+2Al2Cl3.
(4)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要捕述实验步骤、现象和结论)取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应.
仪器自选;可供选择试剂如下:①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某实验小组设计了电化学方法进行二氧化硫的回收利用.利用电化学法将尾气中的SO2气体转化为氮肥硫酸铵,模拟装置如图2:试写出SO2气体发生的电极反应式为SO2-2e-+2NH3•H2O=S042-+2NH4++2H+.
分析 Ⅰ.火法炼铜是利用Cu2S与氧气在高温条件下反应生成Cu与二氧化硫,该工艺的中间过程会发生反应为:2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑;
Ⅱ.利用电解法进行粗铜提纯时,粗铜应作阳极,连接电源正极,发生氧化反应,发生反应有:Cu-2e-=Cu2+、Fe-2e-=Fe2+、Zn-2e-=Zn2+,精铜作阴极,连接电源负极,发生还原反应:Cu2++2e-=Cu,活泼性比Cu弱金属Ag、Pt等金属在电解槽底部会形阳极泥,阳极得到的Cu2+比阴极反应的Cu2+少,整个过程溶液中的Cu2+浓度减少;
Ⅲ.Cu丝在空气中加热生成CuO,并趁热插入到乙醇中,CuO与乙醇反应生成乙醛与Cu;
Ⅳ.(1)用品红溶液检验二氧化硫;
(2)根据装置能否防止溶液倒吸分析解答;
(3)由流程图可知,氯化炉中氧化铝、碳、氯气反应生成氯化铝、CO;
(4)二氧化硫溶液与氯水都可以使品红溶液褪色,据此设计实验;
(5)二氧化硫失去电子,在氨水存在条件下生成硫酸铵,有氢离子生成.
解答 解:Ⅰ.火法炼铜是利用Cu2S与氧气在高温条件下反应生成Cu与二氧化硫,反应方程式为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 ,该工艺的中间过程会发生反应为:2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑,生成二氧化硫为$\frac{5.6L}{22.4L/mol}$=0.25mol,反应中S元素化合价由-2价升高为+4价,转移电子为0.25mol×[4-(-2)]=1.5mol,
故答案为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 ;1.5;
Ⅱ.A.利用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极,故A错误;
B.电解时阳极发生氧化反应,阴极发生还原反应,故B错误;
C.粗铜应作阳极,连接电源正极,其电极反应是Cu-2e-=Cu2+,故C错误;
D.阳极发生反应有:Cu-2e-=Cu2+、Fe-2e-=Fe2+、Zn-2e-=Zn2+,活泼性比Cu弱金属Ag、Pt等金属在电解槽底部会形阳极泥,故D正确;
E.阳极得到的Cu2+比阴极反应的Cu2+少,整个过程溶液中的Cu2+浓度减少,故E正确,
故选:DE;
Ⅲ.Cu丝在空气中加热生成CuO,并趁热插入到乙醇中,CuO与乙醇反应生成乙醛与Cu,铜丝表面的现象为:铜丝表面先变黑,后变为红色,发生的反应为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CuO+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O,
故答案为:铜丝表面先变黑,后变为红色;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CuO+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O;
Ⅳ.(1)用品红溶液检验二氧化硫,具有二氧化硫的方法为:将气体通入品红中,品红褪色,加热后又恢复红色,证明有SO2,
故答案为:将气体通入品红中,品红褪色,加热后又恢复红色,证明有SO2;
(2)a.干燥管球形处容积较大,溶液倒吸后会于烧杯内的液体分离,由重力作用又回到烧杯内,可以防止倒吸,故a正确;
b.广口瓶中进气管长,出气管短,不能防止倒吸,应进气管短,故b错误;
c.导管直接伸入液面内,会发生倒吸危险,故c错误;
d.二氧化硫经过四氯化碳后,被氢氧化钠溶液吸收,可以防止倒吸,故d正确,
故选:ad;
(3)由流程图可知,氯化炉中氧化铝、碳、氯气反应生成氯化铝、CO,反应方程式为:3C+Al2O3+3Cl2$\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3,
故答案为:3C+Al2O3+3Cl2$\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3;
(4)取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应,
故答案为:取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应;
(5)二氧化硫失去电子,在氨水存在条件下生成硫酸铵,有氢离子生成,电极反应式为:SO2-2e-+2NH3•H2O=S042-+2NH4++2H+,
故答案为:SO2-2e-+2NH3•H2O=S042-+2NH4++2H+.
点评 本题考查化学与技术、铜的精炼、实验制备方案设计、原电池等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
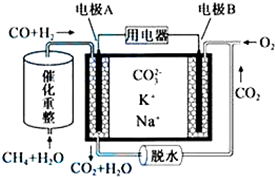
| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
| A. | LiAlH4中H元素的化合价为-1 | |
| B. | LiAlH4L、iAlO2、LiH均是离子化合物 | |
| C. | 1mol LiAlH4在125℃完全分解,转移4mol电子 | |
| D. | 0.5 mol LiAlH4与水充分反应后产生44.8L H2 |
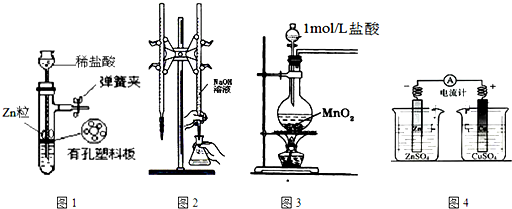
| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置制取少量Cl2 | |
| D. | 用图4所示装置确定导线中有电流通过及并确定电流方向 |
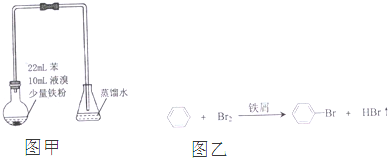
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为: