10.下列化学方程式书写正确的是( )
| A. | 2Na2O2+2H2O═4NaOH | |
| B. | 2S+3O2═2SO3 | |
| C. | 3NO2+2H2O═3HNO3 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
9.下列化学方程式书写不正确的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SiO2+H2O═H2SiO3 | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | 2H2S+SO2═3S+2H2O |
7.在298K时,2molH2燃烧生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2+O2=2H2O,△H=-484kJ/mol | B. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(l),△H=-484kJ/mol | D. | H2(g)+O2(g)=H2O(g)△H=+242kJ/mol |
3.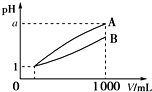 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A. | 若a=4,则A是强酸,B是弱酸 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | A、B两种酸溶液的物质的量浓度一定不相等 | |
| D. | 若1<a<4,则A、B都是弱酸 |
2.在NH3•H2O?NH4++OH-形成的平衡中,要使NH3•H2O的电离程度及[OH-]都增大,可采取的措施是( )
| A. | 通入HCl | B. | 加少量NaOH固体 | C. | 加水 | D. | 升温 |
1.蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH
请回答:
(1)步骤Ⅱ中加入适量的0.1mol•L-1H2O2的目的是将Fe2+氧化成Fe3+;可用于调节溶液pH至7~8的最佳试剂是A(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH
(2)工业上常以Mg2+的转化率为考查指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.
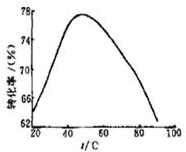
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”反应)
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
0 168452 168460 168466 168470 168476 168478 168482 168488 168490 168496 168502 168506 168508 168512 168518 168520 168526 168530 168532 168536 168538 168542 168544 168546 168547 168548 168550 168551 168552 168554 168556 168560 168562 168566 168568 168572 168578 168580 168586 168590 168592 168596 168602 168608 168610 168616 168620 168622 168628 168632 168638 168646 203614
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol•L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)步骤Ⅱ中加入适量的0.1mol•L-1H2O2的目的是将Fe2+氧化成Fe3+;可用于调节溶液pH至7~8的最佳试剂是A(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH
(2)工业上常以Mg2+的转化率为考查指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.

①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”反应)
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
 △H=+88.6kJ•mol-1则M、N相比,较稳定的是M.
△H=+88.6kJ•mol-1则M、N相比,较稳定的是M. 纯醋酸中不断加入水后,导电能力与加水量的关系如图,请回答有关a、b、c三个点表示的问题:
纯醋酸中不断加入水后,导电能力与加水量的关系如图,请回答有关a、b、c三个点表示的问题: