题目内容
3.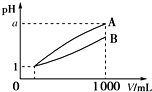 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A. | 若a=4,则A是强酸,B是弱酸 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | A、B两种酸溶液的物质的量浓度一定不相等 | |
| D. | 若1<a<4,则A、B都是弱酸 |
分析 由图可知,稀释相同的倍数,A的pH变化大,则A的酸性比B的酸性强,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+),以此来解答.
解答 解:A.由图知,稀释相同的倍数,A的pH变化大,则A的酸性比B的酸性强,如果a=4,则A是强酸,B是弱酸,故A正确;
B.稀释后,B溶液中氢离子浓度大于A,氢离子浓度越大溶液的酸性越强,所以A溶液的酸性小于B,故B错误;
C.由图可知,开始的pH相同,两种溶液稀释后pH不同,则酸性强弱一定不同,所以物质的量浓度一定不相等,故C正确;
D.若A和B都是弱酸,加水稀释时促进弱酸电离,所以溶液中pH为4>a>1,故D正确;
故选B.
点评 本题考查酸的稀释及图象,明确强酸在稀释时pH变化程度大及酸的浓度与氢离子的浓度的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
8.多电子原子中,原子轨道能量高低排列错误的是( )
| A. | 2px<2py<2p | B. | 2s<3s<4s z | C. | 3s<3p<3d | D. | 2px=2py=2pz |
15.下列对于NaCl的正确叙述是( )
| A. | NaCl是氯化钠晶体的分子式 | |
| B. | 氯化钠晶体中一个钠离子吸引一个氯离子 | |
| C. | NaCl晶体中不存在单个分子 | |
| D. | Na+和Cl-的基态最外层电子排布都是3s23p6 |
15.下列物质露置于空气中易变质的是( )
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠.
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠.
| A. | 除⑤外 | B. | 除②③外 | C. | 除②③⑥外 | D. | 全部易变质 |
13.某无色溶液与铝反应产生氢气,则在溶液中不可能大量共存的离子组为( )
| A. | Na+,Fe3+,NO3-,Cl- | B. | K+,Na+,Cl-,SO42- | ||
| C. | K+,CO32-,Na+,Cl- | D. | Mg2+,Cl-,K+,SO42- |

 ,属离子化合物(填“离子”或“共价”);
,属离子化合物(填“离子”或“共价”);