题目内容
8.(1)写出298K时,下列反应的热化学方程式:3mol NO2(g)与1molH2O(l)反应生成HNO3和NO,放热138kJ.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138 kJ/mol(2)含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1
(3)火箭和导弹表面的薄层是耐高温物质.将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1 176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为98kJ.
分析 (1)3molNO2反应放出138kJ热量,则△H=-138 kJ/mol;
(2)含NaOH 20.0g的稀溶液中含有0.5mol氢氧化钠,与足量稀盐酸反应放出28.7kJ的热量,则1molNaOH反应放热57.4kJ;
(3)所给反应中转移12个电子,故每转移1mol电子放出的热量为1 176kJ÷12=98kJ.
解答 解:(1)3molNO2反应放出138kJ热量,△H=-138 kJ/mol,则热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138 kJ/mol,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138 kJ/mol;
(2)含NaOH 20.0g的稀溶液中含有0.5mol氢氧化钠,与足量稀盐酸反应放出28.7kJ的热量,则该热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1;
(3)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJ•mol-1,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ,
故答案为:98kJ;
点评 本题考查了化学反应能量变化、中和热概念分析判断、氧化还原反应电子转移的计算应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
15.按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )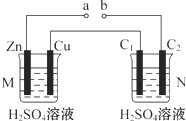

| A. | a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 | |
| B. | a、b连接,装置M中若有0.1 mol SO42-移到Cu电极,装置N中C2极放出H2 2.24 L(标准状况) | |
| C. | a、b未连接时,装置N中C1电极上有气体析出 | |
| D. | 不论a、b是否连接,装置M中观察到的实验现象相同 |
13.现有四种晶体的晶胞,其离子排列方式如图所示,其中对应化学式正确的是( )
| A. | 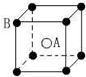 AB2 | B. | 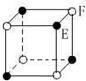 EF2 | C. | 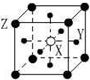 XY3Z | D. | 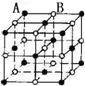 AB3 |
3.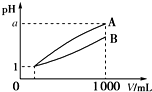 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A. | 若a=4,则A是强酸,B是弱酸 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | A、B两种酸溶液的物质的量浓度一定不相等 | |
| D. | 若1<a<4,则A、B都是弱酸 |
13.在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是( )
| A. | 1:0.45 | B. | 1:1 | C. | 1:0.29 | D. | 4.5:2.9 |
17.下列物质互为同位素的一组是( )
| A. | 12C和14C | B. | NO和NO2 | C. | 12CO和14CO | D. | 14N和14C |
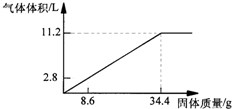 在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,如图表示加入固体的质量与产生气体的体积(标准状况)的关系.试计算:
在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,如图表示加入固体的质量与产生气体的体积(标准状况)的关系.试计算: