7.下列说法正确的是( )
| A. | VSEPR模型就是分子的空间构型 | |
| B. | 在共价化合物分子中一定存在σ键 | |
| C. | Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6 | |
| D. | 共价键键长越短,键能一定越大 |
6.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z的电负性大小顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | Y、Z形成的分子的空间构型可能是正四面体 | |
| D. | 若有WY2,则WY2分子中σ键与π键的数目之比是2:1 |
5.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子.下列有关这些元素性质的说法一定正确的是( )
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
4.同主族元素形成的同一类化合物往往在结构和性质上很相似.化合物PH4I是一种白色晶体,则对PH4I的叙述不正确的是( )
| A. | 它可由PH3和HI化合而成 | |
| B. | 加热时PH4I可以分解,而且有颜色变化 | |
| C. | 它可以跟NaOH反应 | |
| D. | 它是一种共价化合物 |
3.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径 | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6,-2 | -2 |
| A. | 金属性:C>A | B. | 氢化物的稳定性:H2D<H2E | ||
| C. | 单质与稀盐酸反应的速率:A<B | D. | 单质的熔点:A>B>E |
2.下列说法正确的是( )
| A. | 共价键都具有方向性 | |
| B. | σ键是镜像对称,而π键是轴对称 | |
| C. | π键是由两个p电子“肩并肩”重叠形成的 | |
| D. | σ键 都是由两个p轨道“头碰头”重叠形成的 |
1.下列说法正确的是( )
| A. | 氢键不是化学键 | |
| B. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
20.下列说法正确的是( )
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
19.下列说法中正确的是( )
0 168446 168454 168460 168464 168470 168472 168476 168482 168484 168490 168496 168500 168502 168506 168512 168514 168520 168524 168526 168530 168532 168536 168538 168540 168541 168542 168544 168545 168546 168548 168550 168554 168556 168560 168562 168566 168572 168574 168580 168584 168586 168590 168596 168602 168604 168610 168614 168616 168622 168626 168632 168640 203614
| A. | 沸点:PH3>NH3>H2O | |
| B. | CO2分子中的化学键为非极性键 | |
| C. | NH3分子中N原子的杂化轨道类型是sp2 | |
| D. | NH4+为正四面体结构,可推测出PH4+也为正四面体结构 |
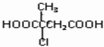 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)