4.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成64 g SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 在此反应中,浓硫酸表现出酸性和氧化性 |
3.50mL18mol/L的H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为( )
| A. | <0.45mol | B. | 0.45mol | ||
| C. | 0.45-0.90mol之间 | D. | >0.90mol |
1.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)C、G两元素的最高价氧化物对应水化物相互反应的离子方程是:Al(OH)3+OH-=AlO2-+2H2O
(2)在一定条件下,A与E可形成化合物的化学式是NH3,其水溶液呈碱性(填“酸”、“碱”或“中”).
(3)写出A与F形成化合物的电子式 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)在一定条件下,A与E可形成化合物的化学式是NH3,其水溶液呈碱性(填“酸”、“碱”或“中”).
(3)写出A与F形成化合物的电子式
 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
20.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只存在ClO-.
②要证明假设1是否成立,设计实验方案,进行实验.请在答题卡上写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只存在ClO-.
②要证明假设1是否成立,设计实验方案,进行实验.请在答题卡上写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
16.下列关于电离能和电负性的说法不 正确的是( )
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳 | |
| D. | 元素的第一电离能:Al<Si |
15.下列描述中正确的是( )
0 168370 168378 168384 168388 168394 168396 168400 168406 168408 168414 168420 168424 168426 168430 168436 168438 168444 168448 168450 168454 168456 168460 168462 168464 168465 168466 168468 168469 168470 168472 168474 168478 168480 168484 168486 168490 168496 168498 168504 168508 168510 168514 168520 168526 168528 168534 168538 168540 168546 168550 168556 168564 203614
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
 .
. .
. ②NaOH
②NaOH ③NH3
③NH3 ④N2
④N2
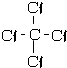 ③NH3
③NH3 ④H2SH-S-H.
④H2SH-S-H.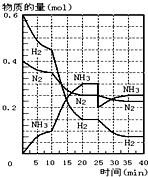 (1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
(1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图: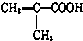 )$\stackrel{一定条件}{→}$PMAA
)$\stackrel{一定条件}{→}$PMAA .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O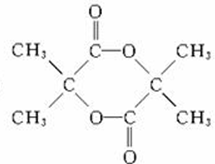 .
. ③
③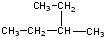 ④
④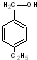 ⑤
⑤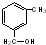 ⑥
⑥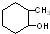
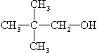 .
.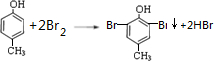 .
.