9.A、B、C、D、E是元素周期表中前四周期中五种常见元素,原子序数逐渐增大.相关信息如下表:
请回答下列问题:
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
| 元素 | 相关信息 |
| A | 基态原子核外三个能级有电子,且每个能级上电子数目相同 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 单质为常见金属,离子半径在同周期中最小 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 有多种化合价,有一种氧化物为黑色磁性晶体 |
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
8.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 1mol苯乙烯中含有的C=C数为4NA | |
| B. | 1mol甲醇中含有C-H键的数目为4NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1NA | |
| D. | 1molC4H10中含有共用电子对数是13NA |
7.中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法.下列说法中正确的是( )
| A. | 氢键是自然界中最重要、存在最广泛的化学键之一 | |
| B. | 正是氢键的存在,冰能浮在水面上 | |
| C. | 由于氢键的存在,沸点:HCl>HBr>HI>HF | |
| D. | 由于氢键的存在,水分子变的更稳定了 |
5.下列有关化学用语表示正确的是( )
| A. | HClO的电子式: | |
| B. | 中子数为20的氯原子:1720Cl | |
| C. | CCl4的电子式: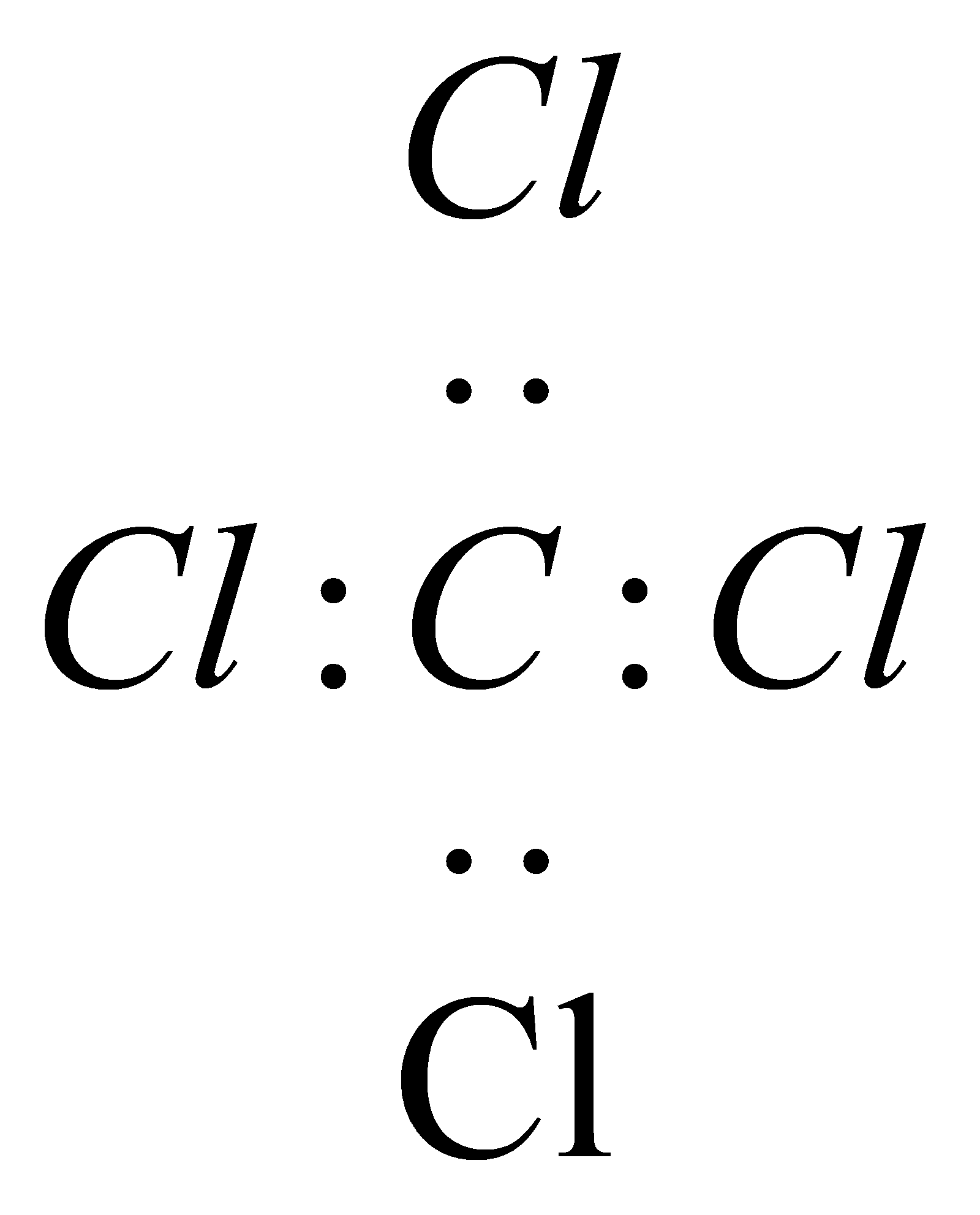 | |
| D. | Cl-的结构示意图: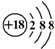 |
4.下列有关热化学方程式及其叙述正确的是( )
| A. | 氢气的燃烧热为-285.5kJ/mo1,则电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5kJ/mo1 | |
| B. | 1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,则它的热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1)△H=-445kJ/mol | |
| C. | 已知:2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热为-110.5kJ/mo1 | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol |
3.关节炎的病因主要是在关节滑液中形成了尿酸钠晶体,主要反应为:Ur-+Na+?NaUr(s);又知,关节炎发作多在脚趾和手指的关节处,有关该反应的说法正确的是( )
| A. | 正反应是吸热反应 | B. | 正反应是放热反应 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 以上说法都不正确 |
2.在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8mol/L和5.4mol/L,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8mol/L,则在这10min内NH3的平均反应速率是( )
| A. | 0.1 mol/(L•min) | B. | 0.2 mol/(L•min) | C. | 0.3 mol/(L•min) | D. | 0.6 mol/(L•min) |
1.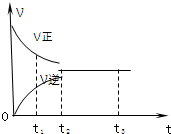 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应不再发生 | D. | t2-t3,各物质的浓度还在发生变化 |
20.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
0 168324 168332 168338 168342 168348 168350 168354 168360 168362 168368 168374 168378 168380 168384 168390 168392 168398 168402 168404 168408 168410 168414 168416 168418 168419 168420 168422 168423 168424 168426 168428 168432 168434 168438 168440 168444 168450 168452 168458 168462 168464 168468 168474 168480 168482 168488 168492 168494 168500 168504 168510 168518 203614
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 75 | 74 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 四种元素形成的单核离子半径由大到小的顺序为:Z3->W2->X2+>Y3+ |