题目内容
5.下列有关化学用语表示正确的是( )| A. | HClO的电子式: | |
| B. | 中子数为20的氯原子:1720Cl | |
| C. | CCl4的电子式: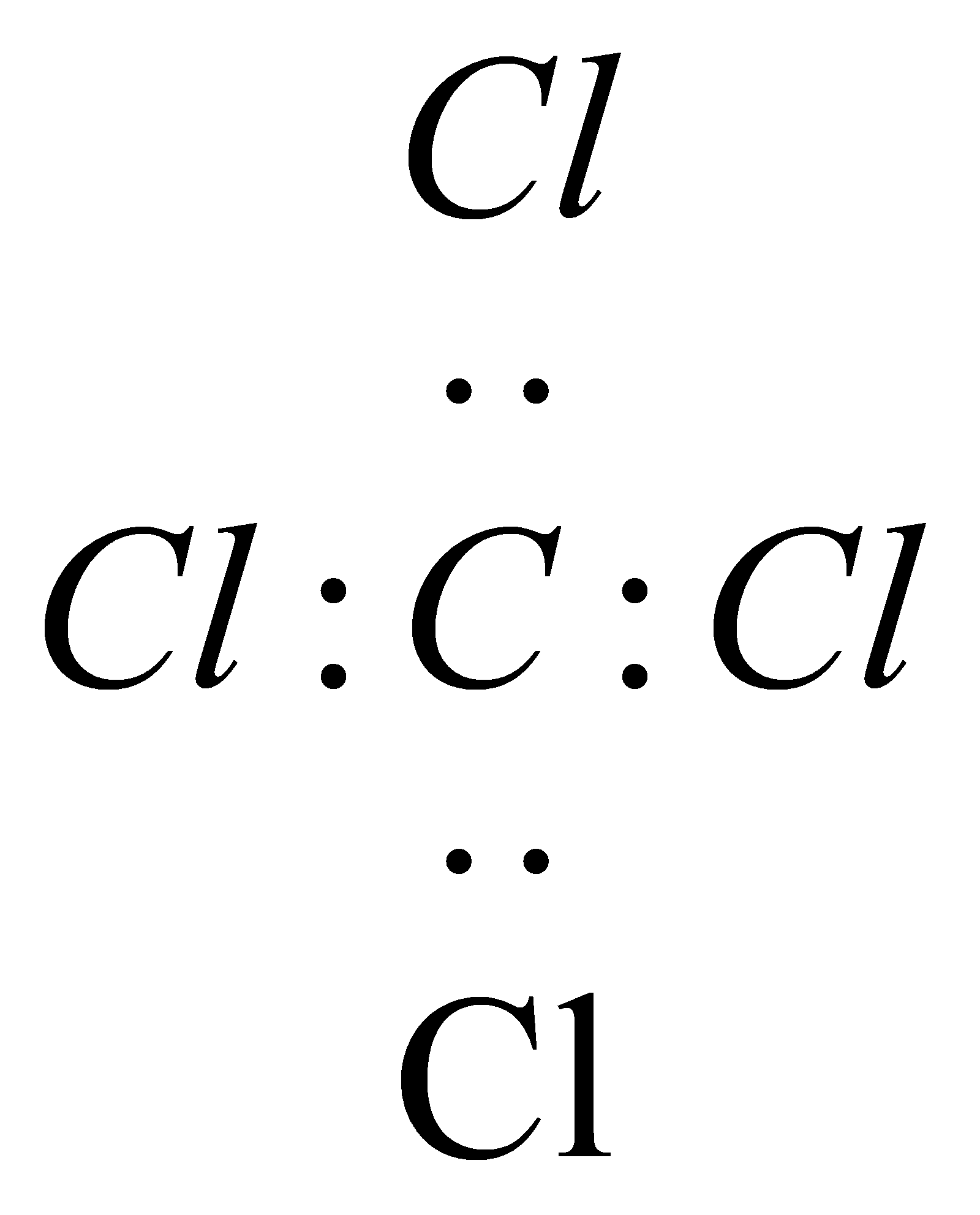 | |
| D. | Cl-的结构示意图: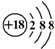 |
分析 A.氯原子最外层7个电子成1个共价键、氧原子的最外层6个电子,成2个共价键;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.四氯化碳的电子式中漏掉了氯原子的3对孤电子对;
D.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构.
解答 解:A.次氯酸为共价化合物,分子中存在1个氧氢键和1个氢氯键,次氯酸的电子式为: ,故A正确;
,故A正确;
B.中子数为20的氯原子的质量数为 37,该原子正确的表示方法为:1737Cl,故B错误;
C.四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为: ,故C错误;
,故C错误;
D.氯离子和氯原子的核电荷数都是17,氯离子正确的离子结构示意图为: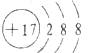 ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式、离子结构示意图、元素符号的表示方法,题目难度中等,注意掌握常见化学用语的概念及正确的书写方法,明确原子结构示意图与离子结构示意图、离子化合物的与共价化合物的电子式的区别,试题培养了学生规范答题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.X、Y、Z、W为四种短周期主族元素.其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | Y元素最高价氧化物对应水化物的化学式为H2YO4 | |
| B. | X与W可以形成W2X、W2X2两种化合物 | |
| C. | Z的氢化物的沸点比X的氢化物的沸点高 | |
| D. | Y、Z两元素的简单离子的半径Y>Z |
13.下列各组物质中,满足表中图示物质在通常条件下能一步转化的组合只有( )
| 序号 | X | Y | Z | W |  |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A. | ①②③ | B. | ①③④ | C. | ②③ | D. | ①②④ |
20.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 75 | 74 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 四种元素形成的单核离子半径由大到小的顺序为:Z3->W2->X2+>Y3+ |
10.下列各组物质中,一定互为同系物的是( )
| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. |  和 和  | D. | HCHO、CH3COOH |
14.元素周期表中某一区域的一些元素有着某些相似的用途,可以研发新材料或新药物,下列说法可能错误的是( )
| A. | 在金属与非金属分界处寻找半导体材料 | |
| B. | 在周期表的左上方区域开发新核能 | |
| C. | 在右上方活泼非金属区域寻找新药物 | |
| D. | 在过渡元素区域寻找催化剂和耐高温、耐腐蚀的新材料 |
 单质甲能发生如下变化(反应条件均未标明),其中A、B、C、D中都含有相同的一种元素,试举出两组符合题意的实例,写出对应各物质的分子式
单质甲能发生如下变化(反应条件均未标明),其中A、B、C、D中都含有相同的一种元素,试举出两组符合题意的实例,写出对应各物质的分子式