9.下列有关实验的做法或说法正确的是( )
| A. | 在制备乙烯的实验中,加热时应使温度缓慢上升至170°C | |
| B. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| C. | 将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
8.下列过程属于氧化反应的是( )
| A. | 乙醇?乙醚 | B. | 乙醛?乙酸 | C. | 乙醛?乙醇 | D. | 乙酸?乙酸乙酯 |
7.下列各组混合物中,不能互溶的是( )
| A. | 乙醇和碘水 | B. | 乙醇和乙酸 | C. | 甲醛和水 | D. | 苯和水 |
6.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为互为同位素;R在元素周期表中的位置是第3周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
| X | Y | Z | M | R | Q | |
| 原子半 径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要 化合价 | -4, +4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
5.一定温度下反应2SO2(g)+O2(g)?2SO3(g)达到化学平衡状态的标志是( )
| A. | SO2,O2和SO3的体积分数不再改变 | |
| B. | c(SO2):c(O2):c(SO3)=2:1:2 | |
| C. | SO2与O2的物质的量之和是SO3的物质的量2倍 | |
| D. | 单位时间里每增加2molSO2,同时增加1molO2 |
4.下列四种X溶液,均能跟相同浓度同体积的盐酸反应,其中反应最快的是( )
| 温度 | X溶液的体积(mL) | X溶液的浓度(mol/L) | 水的体积(mL) | |
| A | 10℃ | 20 | 3 | 10 |
| B | 20℃ | 30 | 2 | 0 |
| C | 20℃ | 10 | 4 | 20 |
| D | 10℃ | 10 | 2 | 20 |
| A. | A | B. | B | C. | C | D. | D |
3.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
2.下列关于能源和作为能源的物质的叙述中错误的是( )
| A. | 化石能源物质内部蕴储着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 物质的化学能可以在不同条件下转为热能、电能为人类所利用 | |
| D. | 我国经济发展要全部依靠化石能源 |
1.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(用推断出的元素符号回答问题)
(1)Z位于元素周期表第三周期第ⅦA族,Y的氢化物电子式是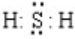 .
.
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S,对应氢化物较稳定的是HCl.
(3)写出X的单质与Y的最高价氧化物对应水化物的浓溶液反应的方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)写出W元素的原子核外价电子排布式3d104s1.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Z位于元素周期表第三周期第ⅦA族,Y的氢化物电子式是
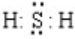 .
.(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S,对应氢化物较稳定的是HCl.
(3)写出X的单质与Y的最高价氧化物对应水化物的浓溶液反应的方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)写出W元素的原子核外价电子排布式3d104s1.
20.下列分离方法中,正确的是( )
①用蒸馏法分离乙醇和水的混合物
②用升华法分离碘和砂子的混合物
③用重结晶法提纯苯甲酸
④用分液法分离苯和溴苯的混合物.
0 168316 168324 168330 168334 168340 168342 168346 168352 168354 168360 168366 168370 168372 168376 168382 168384 168390 168394 168396 168400 168402 168406 168408 168410 168411 168412 168414 168415 168416 168418 168420 168424 168426 168430 168432 168436 168442 168444 168450 168454 168456 168460 168466 168472 168474 168480 168484 168486 168492 168496 168502 168510 203614
①用蒸馏法分离乙醇和水的混合物
②用升华法分离碘和砂子的混合物
③用重结晶法提纯苯甲酸
④用分液法分离苯和溴苯的混合物.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |