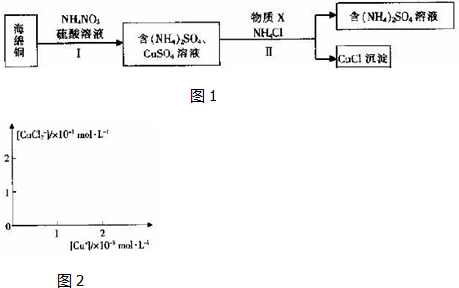
5. Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明温度对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,温度越高反应速率越快.
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
 Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
4.实验设计和判断.为了研究过氧化氢分解速率,请回答下列问题.
(1)填写实验报告(填写空白处)
(2)过氧化氢分解的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
(1)填写实验报告(填写空白处)
| 目的 | 操作(文字或图示) | 实验现象 |
| ①催化剂 的影响 | ||
②温度的影响 | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | |
③浓度的影响 | 取两支试管分别加入5mL 5%H2O2溶液和5mL10%H2O2溶液 | 看不到明显的 实验现象 |
(3)如何改进③的实验因为浓度低很难看出不同,将两支试管同时放入盛有热水的烧杯中,或向两支试管中同时滴入1-2滴1mol/LFeCl3溶液,观察产生气泡的速率.
(4)实验结论温度、催化剂、浓度等因素都是影响过氧化氢分解速率的外界因素.
3. 为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)实验①的目的是验证其他条件相同时,温度对化学反应速率的影响,实验中滴加FeCl3溶液的目的是催化剂,加快化学反应速率.
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是③(填序号).
①加热5%H2O2溶液 ②分别加入5mL5%H2O2③加入1~2 滴1mol/L FeCl3溶液
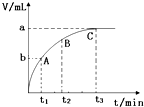
(3)某同学在50mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
 为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是③(填序号).
①加热5%H2O2溶液 ②分别加入5mL5%H2O2③加入1~2 滴1mol/L FeCl3溶液
(3)某同学在50mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
2.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |
1.下列有关物质用途的说法中,不正确的是( )
| A. | 四氯化碳可做有机溶剂 | |
| B. | 可用工业酒精勾兑白酒 | |
| C. | 甲烷是清洁高效的燃料 | |
| D. | 用二氯甲烷只有一种结构证明甲烷空间结构是正四面体 |
20.居里夫人发现的镭是主族元素,镭原子核存有7个电子层,最外层上只有2个电子,下列关于它的描述中错误的是( )
| A. | 在化合物中呈现+2价 | B. | 它的氢氧化物呈两性 | ||
| C. | 原子半径在本族元素中最大 | D. | 单质与水反应能放出氢气 |
19.下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是( )
0 168259 168267 168273 168277 168283 168285 168289 168295 168297 168303 168309 168313 168315 168319 168325 168327 168333 168337 168339 168343 168345 168349 168351 168353 168354 168355 168357 168358 168359 168361 168363 168367 168369 168373 168375 168379 168385 168387 168393 168397 168399 168403 168409 168415 168417 168423 168427 168429 168435 168439 168445 168453 203614
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 | 可以加快制取氢气的速度 | Ⅰ对、Ⅱ对、无 |
| B | 用Mg-Al-NaOH构成原电池 | Mg更活泼作负极 | Ⅰ对、Ⅱ对、无 |
| C | 石墨常用做电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对、Ⅱ对、有 |
| D | MgCl2是离子化合物 | 电解MgCl2的饱和溶液制取金属镁 | Ⅰ对、Ⅱ对、有 |
| A. | A | B. | B | C. | C | D. | D |
 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.