题目内容
3. 为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是③(填序号).
①加热5%H2O2溶液 ②分别加入5mL5%H2O2③加入1~2 滴1mol/L FeCl3溶液
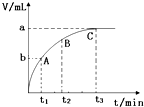
(3)某同学在50mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
分析 (1)试管A、B中除了反应温度不同,其它条件完全相同,据此判断实验目的;
(2)根据双氧水浓度不同可知,实验②是探究浓度对反应速率的影响,由于反应速率较小,可以同时改变反应条件,如都加入催化剂;
(3)根据速率的表示方法和图象横坐标和纵坐标的意义解答
解答 解:(1)分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液,待试管中均有适量气泡出现,说明过氧化氢分解能发生,试管A、B中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中,两支试管不同点是试管A的温度比试管B的温度低,说明研究的是温度对反应速率的影响,而开始加滴加FeCl3溶液,目的加快H2O2分解,
故答案为:验证其他条件相同时,温度对化学反应速率的影响;催化剂,加快化学反应速率;
(2)影响化学反应速率的外界因素有浓度、温度、气体的压强、催化剂、固体的表面积,另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液,试管A、B中均未见气泡产生,为加快反应速率,可从温度或催化剂的影响角度考虑,但必须同时改变条件,而①加热5%H2O2溶液,违反了变量的唯一性;②分别加入5mL5%H2O2,反应仍然不会有明显现象;只有③加入1~2 滴1mol/L FeCl3溶液,加入催化剂,大大加快反应速率,故③正确,
故答案为:③;
(3)该图象横坐标表示时间,纵坐标表示生成气体的体积,时间越短生成的气体越多,反应速率越快,所以反应速率最慢的为C,
故答案为:C.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,侧重考查学生的实验探究能力,明确实验目的为解答关键,注意熟练掌握温度、浓度、催化剂等因素对反应速率的影响.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案| A. | 减少炭的量 | B. | 保持体积不变,增加水蒸气的量 | ||
| C. | 将容器体积缩小一半 | D. | 保持压强不变,充入Ne |
| A. | 2,2一二甲基丙醇和2一甲基丁醇 | B. | 邻氯甲苯和对氯甲苯 | ||
| C. | 2一甲基丁烷和戊烷 | D. | 1-丁烯与2-甲基丁烯 |
| A. | Na | B. | Mg | C. | Al | D. | Cl |
| A. | 通入溴水中观察溶液颜色的变化 | B. | 嗅闻它们的气味 | ||
| C. | 比较它们在水中的溶解度大小 | D. | 点燃它们后,观察火焰 |
| A. | 氮气 | B. | 氯气 | C. | 二氧化碳 | D. | 二氧化硫 |
| A. | 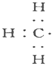 --甲基的电子式 --甲基的电子式 | B. | 甲烷的结构式:CH4 | ||
| C. | CH3-CH=CH-CH3的键线式: | D. | 苯的分子式: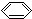 |
| A. | $\frac{a}{A}$(A-Z+m)mol | B. | $\frac{a}{A}$(A-Z)mol | C. | $\frac{a}{A+m}$(A-Z)mol | D. | $\frac{a}{A+m}$(A-Z+m)mol |