16.下列玻璃仪器中不能直接加热的是( )
| A. | 烧杯 | B. | 蒸发皿 | C. | 蒸馏烧瓶 | D. | 试管 |
13.某烃的结构简式为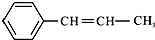 ,它可能具有的性质是( )
,它可能具有的性质是( )
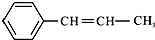 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 不溶于水,易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为: | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
10.下列实验现象描述或说法不正确的是( )
| A. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为$\frac{1}{22.4}$ mol/L | |
| B. | 氨很容易液化,因此氨常用作制冷剂 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
8.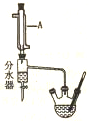 实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
请回答下列问题.I.乙醇正丁酯粗产品的制备在三颈圆底烧瓶中加入沸石,18.5mL正丁醇和15.4mL冰醋酸,再加3-4滴浓硫酸,加热使之反应.图中分水器的作用是在实验过程中,不断分离除去反应生成的水.
(1)仪器A的名称冷凝管.
(2)反应时加热有利于提高的产率,但温度过高酯的产率反而降低,其可能的原因是温度过高时,正丁醇、乙酸易挥发,且副反应增加,导致酯产率降低.
(3)用分水器分出冷凝水的目的使用分水器分离出水,使平衡正向移动,提高反应产率,步骤I中判断反应终点的依据是分水器中的水层量不再增加.
II.乙酸正丁酯粗产品的精制:
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步骤作的目的是饱和Na2CO3溶液可溶解正丁醇,中和酸,从而除去产品中的杂质
(2)用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是有机层从分液漏斗上口倒入一个干燥的蒸馏烧瓶中.
(3)将酯层进行蒸馏.蒸馏手机乙酸正丁酯产品时,应将温度控制在126.1℃左右.
III.计算产率:称量制得的乙酸正丁酯的质量为12.76g,则乙酸正丁酯的产率为55%.
0 168102 168110 168116 168120 168126 168128 168132 168138 168140 168146 168152 168156 168158 168162 168168 168170 168176 168180 168182 168186 168188 168192 168194 168196 168197 168198 168200 168201 168202 168204 168206 168210 168212 168216 168218 168222 168228 168230 168236 168240 168242 168246 168252 168258 168260 168266 168270 168272 168278 168282 168288 168296 203614
 实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度g.cm-3 | 沸点/ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)仪器A的名称冷凝管.
(2)反应时加热有利于提高的产率,但温度过高酯的产率反而降低,其可能的原因是温度过高时,正丁醇、乙酸易挥发,且副反应增加,导致酯产率降低.
(3)用分水器分出冷凝水的目的使用分水器分离出水,使平衡正向移动,提高反应产率,步骤I中判断反应终点的依据是分水器中的水层量不再增加.
II.乙酸正丁酯粗产品的精制:
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步骤作的目的是饱和Na2CO3溶液可溶解正丁醇,中和酸,从而除去产品中的杂质
(2)用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是有机层从分液漏斗上口倒入一个干燥的蒸馏烧瓶中.
(3)将酯层进行蒸馏.蒸馏手机乙酸正丁酯产品时,应将温度控制在126.1℃左右.
III.计算产率:称量制得的乙酸正丁酯的质量为12.76g,则乙酸正丁酯的产率为55%.
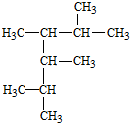 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷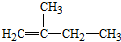 2-甲基-1-丁烯
2-甲基-1-丁烯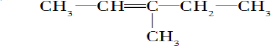 .
. .
. 与
与
 与
与
 与
与
 与
与
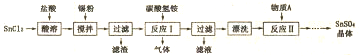
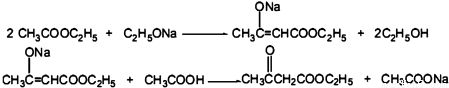

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.