8.下列说法正确的是( )
| A. | 溴乙烷和甲醇都能发生消去反应 | |
| B. | 乙烯和苯都能与酸性KMnO4溶液发生反应 | |
| C. | 纤维素和油脂的水解产物都是葡萄糖 | |
| D. | 糖类和蛋白质都是人体需要的营养物质 |
4. 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )| A. | 放电时电子从A极通过导线流向B极有关 | |
| B. | 放电时A是负极,电极反应式为:LixC6-xe-=C6+xLi+ | |
| C. | 充电时Li+从左边流向右边 | |
| D. | 充电时B作阳极,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+ |
2.W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族;四种元素的原子中半径最大的是X原子.下列说法正确的( )
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族元素的原子次外层电子数可能为2或8,不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
20.X、Y、Z、W、R是五种常见的前四周期元素,原子序数依次增大,其相关信息如下表:
(1)元素W在周期表中的位置是第三周期,第ⅥA族,R基态原子的价电子排布式为3d54s1.
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
0 167935 167943 167949 167953 167959 167961 167965 167971 167973 167979 167985 167989 167991 167995 168001 168003 168009 168013 168015 168019 168021 168025 168027 168029 168030 168031 168033 168034 168035 168037 168039 168043 168045 168049 168051 168055 168061 168063 168069 168073 168075 168079 168085 168091 168093 168099 168103 168105 168111 168115 168121 168129 203614
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.

 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$ +R3COOH
+R3COOH $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CH3COOH
+CH3COOH

 ;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.
;反应II和IV的目的是保护B中的羟基,防止被酸性高锰酸钾氧化.


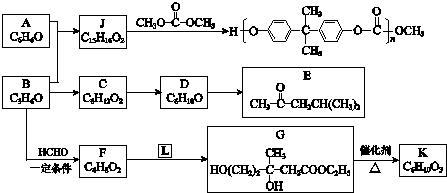
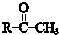 +
+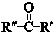 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$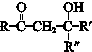 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) .
. .
. .F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3.
.F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3. .
. .
.