10.一定条件下在水溶液中能大量共存的一组分子、离子是( )
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
8.某溶液中含有NH4+,Fe2+,Al3+,SO42-,Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量稀硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
| A. | Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解 | |
| B. | 反应后,溶液中NH4+,Fe2+,SO42-的物质的量减少,而Al3+、Cl-的物质的量不变 | |
| C. | Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化 | |
| D. | 该实验中共有两种气体生成 |
7.用相对分子质量为43的烷基取代烷烃(C4H10)分子中的一个氢原子,所得的有机物有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 7种 | D. | 8种 |
5. 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
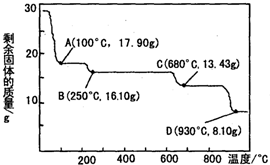
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
①(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”).
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
4.分别依据下列实验事实,得出的结论正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将二氧化硫通入溴水中,溴水褪色 | 二氧化硫有漂白性 |
| B | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液氧化能力增强 |
| C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸反应速率 |
| D | 淀粉与稀硫酸共热,再加银氨溶液水浴加热,无银镜生成 | 淀粉没有水解 |
| A. | A | B. | B | C. | C | D. | D |
3.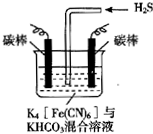 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 |
2. 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵是离子化合物 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
1.某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )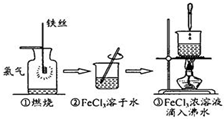
0 167889 167897 167903 167907 167913 167915 167919 167925 167927 167933 167939 167943 167945 167949 167955 167957 167963 167967 167969 167973 167975 167979 167981 167983 167984 167985 167987 167988 167989 167991 167993 167997 167999 168003 168005 168009 168015 168017 168023 168027 168029 168033 168039 168045 168047 168053 168057 168059 168065 168069 168075 168083 203614

| A. | 实验①、③反应制得的物质均为纯净物 | |
| B. | 实验②、③均未发生氧化还原反应 | |
| C. | 实验②、③均为放热反应 | |
| D. | 实验①、②所涉及的物质均为电解质或非电解质 |

 ;反应③
;反应③ .
.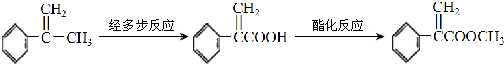



 ,B中的官能团名称是醛基、羟基.
,B中的官能团名称是醛基、羟基. .
. .
.