10.下列物质中,不能通过单质间直接化合得到的是( )
| A. | FeCl3 | B. | CuS | C. | Na2O2 | D. | FeS |
6.为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是( )
| A. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| B. | NaBr溶液(NaI),应加入适量的氯水、CCl4,进行萃取分液 | |
| C. | NH4Cl溶液(FeCl3),应加入适量的氨水,过滤 | |
| D. | CO2(CO),通过过量的灼热的氧化铜粉末 |
4.某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
①该小组在设计方案时,考虑了浓度、温度、催化剂等因素对H2O2分解速率的影响.
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
①写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
2.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)≒Y(g)+Z (s),以下能说明作为反应达到平衡标志的是( )
| A. | X的分解速率与Y的消耗速率相等 | |
| B. | X、Y与Z的物质的量之比为2:1:1 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解1mol X |
1.4NH3+5O2≒4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为( )
0 167828 167836 167842 167846 167852 167854 167858 167864 167866 167872 167878 167882 167884 167888 167894 167896 167902 167906 167908 167912 167914 167918 167920 167922 167923 167924 167926 167927 167928 167930 167932 167936 167938 167942 167944 167948 167954 167956 167962 167966 167968 167972 167978 167984 167986 167992 167996 167998 168004 168008 168014 168022 203614
| A. | V(O2)=0.01mol/L•s | B. | V(NO)=0.008mol/L•s | ||
| C. | V(H2O)=0.003mol/L•min | D. | V(NH3)=0.002mol/L•s |
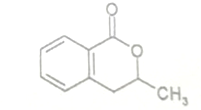
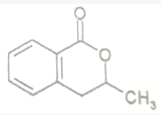 +H2O$\stackrel{NaOH}{→}$
+H2O$\stackrel{NaOH}{→}$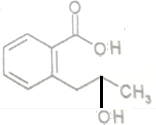 .
.
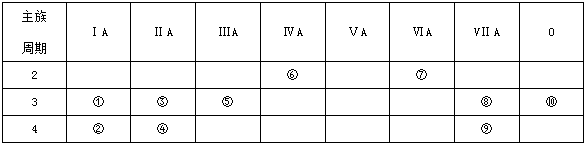
 ,用电子式表示⑦号元素氢化物的形成过程是
,用电子式表示⑦号元素氢化物的形成过程是 ,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.
,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.