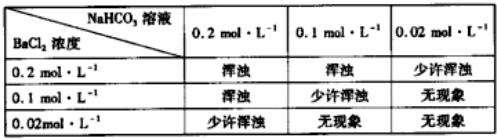
18.下列命名正确的是( )
| A. | 3,3-二甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3,3,4-三甲基戊烷 | D. | 2,3,3-三甲基己烷 |
15.下列说法正确的是( )
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
14.X、Y、Z是三种主族元素,如果Xm+与Yn-具有相同的电子层结构,Zn-半径大于Yn-半径,则三种元素的原子序数由大到小的顺序是( )
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
12.下列表示物质结构的化学用语或说法中,正确的是( )
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: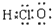 | |
| D. | NaCl的电子式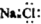 |
11.金属钛(Ti)被称为未来“钢铁”,也称为“太空金属”.对钛元素的同位素${\;}_{22}^{46}$Ti、${\;}_{22}^{47}$Ti、${\;}_{22}^{48}$Ti、${\;}_{22}^{49}$Ti、${\;}_{22}^{50}$Ti,下列说法中不正确的是( )
| A. | 上述同位素中,Ti原子核中的中子数不可能为30 | |
| B. | 题述中包括5种钛原子,即钛元素的5种核素 | |
| C. | 根据题意可求得钛元素的平均相对原子质量为48 | |
| D. | 钛元素属过渡金属元素 |
9.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
0 167746 167754 167760 167764 167770 167772 167776 167782 167784 167790 167796 167800 167802 167806 167812 167814 167820 167824 167826 167830 167832 167836 167838 167840 167841 167842 167844 167845 167846 167848 167850 167854 167856 167860 167862 167866 167872 167874 167880 167884 167886 167890 167896 167902 167904 167910 167914 167916 167922 167926 167932 167940 203614
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
 ;
; ,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H
,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H ,其中含有的化学键类型是离子键和共价键
,其中含有的化学键类型是离子键和共价键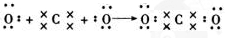 .
.