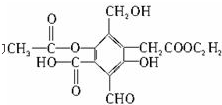
题目内容
17.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:(1)ZW2各原子均满足8电子稳定结构,其电子式是
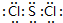 ;
;(2)工业电解熔融Y的氧化物生产单质Y,说明该氧化物是离子 (填离子或共价)化合物;
(3)Y与浓的NaOH溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,X与Y化学性质相似,则X与浓的NaOH溶液反应所得盐的化学式为Na2BeO2.
分析 X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be,X与W、Y与Z两对原子的最外层电子数之和为9,则W的最外层电子数为7,则W为F或Cl元素,且X、Y、Z、W原子序数依次增大,四种元素中有两种金属元素,则W不能为F元素,故W为Cl;Y、Z处于第三周期,则只能Y为金属元素,且能与氢氧化钠溶液反应,故Y为Al;则Z原子最外层电子数为9-3=6,故Z为S元素,据此解答.
解答 解:X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be,X与W、Y与Z两对原子的最外层电子数之和为9,则W的最外层电子数为7,则W为F或Cl元素,且X、Y、Z、W原子序数依次增大,四种元素中有两种金属元素,则W不能为F元素,故W为Cl;Y、Z处于第三周期,则只能Y为金属元素,且能与氢氧化钠溶液反应,故Y为Al;则Z原子最外层电子数为9-3=6,故Z为S元素.
(1)SCl2各原子均满足8电子稳定结构,S原子与Cl原子之间形成1对共用电子对,电子式为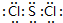 ,故答案为:
,故答案为: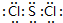 ;
;
(2)工业电解熔融氧化铝生产单质Al,说明氧化铝是离子化合物,故答案为:离子;
(3)Al与浓的NaOH溶液反应的化学方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Be与Al化学性质相似,则Be与浓的NaOH溶液反应所得盐的化学式为Na2BeO2,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Na2BeO2.
点评 本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,解题的突破口是“X原子的最外层电子数与次外层电子数相等”.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
12.下列表示物质结构的化学用语或说法中,正确的是( )
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: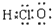 | |
| D. | NaCl的电子式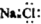 |
2.下列关于甲苯的实验中,能说明苯环对侧链有影响的是( )
| A. | 甲苯硝化生成三硝基甲苯 | B. | 甲苯能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲苯燃烧带有浓厚的黑烟 | D. | 甲苯与氢气可以生加成反应 |
9.某卤代烃中化学键如图所示,则下列说法正确的是( )
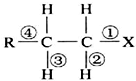

| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
16.工业上设计将VOSO4、SO2杂质除去并回收得到V2O5的流程如下:
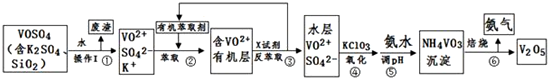
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为1.7-1.8.
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.

请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.