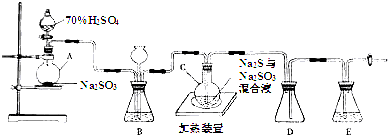
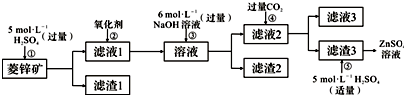
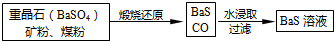
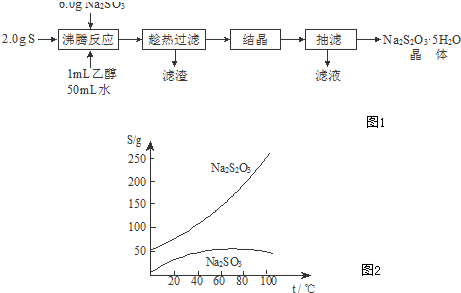
7.下列各选项能说明分子式为C4H6的某烃是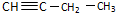 ,而不是
,而不是 的事实是( )
的事实是( )
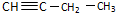 ,而不是
,而不是 的事实是( )
的事实是( )| A. | 燃烧有浓烟 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 所在原子不在同一平面上 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
6. 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
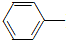 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$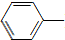 NHCOCH3+H2O
NHCOCH3+H2O
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
实验步骤如下:
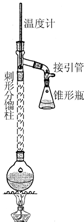
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$ NHCOCH3+H2O
NHCOCH3+H2O已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
3.CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉.工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
FeSO4$\stackrel{①}{→}$FeOOH晶种$\stackrel{②}{→}$FeOOH$\stackrel{③}{→}$Fe2O3$\stackrel{④}{→}$Fe3O4$→_{⑤}^{CoSO_{4}溶液}$
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种.生成晶种的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O;
(2)步骤③将FeOOH固体在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤④通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为排尽装置中的空气,防止氢气与氧气混合反应爆炸.
(4)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4•7H2O晶体.下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液).
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4•7H2O晶体.
FeSO4$\stackrel{①}{→}$FeOOH晶种$\stackrel{②}{→}$FeOOH$\stackrel{③}{→}$Fe2O3$\stackrel{④}{→}$Fe3O4$→_{⑤}^{CoSO_{4}溶液}$
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种.生成晶种的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O;
(2)步骤③将FeOOH固体在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤④通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为排尽装置中的空气,防止氢气与氧气混合反应爆炸.
(4)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4•7H2O晶体.下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4•7H2O晶体.
1.环己酮是一种重要的有机化工原料.实验室合成环己酮的反应为: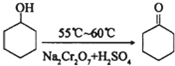
环己醇和环己酮的部分物理性质见下表:
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)从下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度;增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(60.3%).
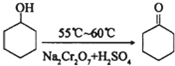
环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)从下关于萃取分液操作的叙述中,不正确的是ABC.

A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度;增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(60.3%).
19.一定物质的量浓度溶液的配置和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配置1mol•L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是( )
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60mL 稀硫酸标准溶液,配制时应选用100ML容量瓶 | |
| C. | 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 | |
| D. | 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| E. | 配制溶液时,定容时俯视度数,则导致实验结果偏大 | |
| F. | 中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
18.Ag2CrO4在水中的沉淀溶解平衡曲线如图所示,t℃时,反应Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)的K=2.5×107,下列说法正确的是( )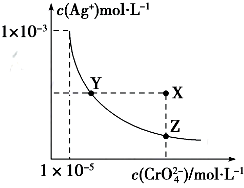
0 167723 167731 167737 167741 167747 167749 167753 167759 167761 167767 167773 167777 167779 167783 167789 167791 167797 167801 167803 167807 167809 167813 167815 167817 167818 167819 167821 167822 167823 167825 167827 167831 167833 167837 167839 167843 167849 167851 167857 167861 167863 167867 167873 167879 167881 167887 167891 167893 167899 167903 167909 167917 203614

| A. | t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃时,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃时,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
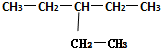 系统命名法:3-乙基戊烷
系统命名法:3-乙基戊烷 系统命名法:6-甲基-3-乙基-2-辛烯
系统命名法:6-甲基-3-乙基-2-辛烯