20.在25℃,101k P的条件下,5.2g C2H2完全燃烧生成CO2和H2O(l)时放出259.92kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 1/5C2H2(g)+1/2O2(g)=2/5CO2(g)+1/5H2O(l)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)=0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2 kJ/mol |
19.下列各组物质中,化学键类型完全相同的一组是( )
| A. | Na2O2和H2O2 | B. | KOH和H2SO4 | C. | CCl4和KCl | D. | MgCl2和Na2O |
18.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )


| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
17.元素在周期表中的位置,能反映原子结构和元素的化学性质,下列有关说法正确的是( )
| A. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| B. | 同一元素不可能既表现金属性,又表现非金属性 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
16.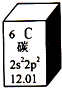 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的相对原子质量为12.01 | |
| D. | 该元素没有同位素,所有原子的中子数均为6 |
15.氰酸铵(NH4CNO)与尿素[CO(NH2)2]( )
| A. | 互为同系物 | B. | 互为同分异构体 | C. | 都是共价化合物 | D. | 都是有机化合物 |
14.下列说法正确的是( )
| A. | H、D、T表示三种氢原子 | |
| B. | 卤族元素最高化合价均为正7价,最低化合价均为负1价 | |
| C. | 金属元素的原子最外层电子数,都少于4个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
13.下列化学用语对应正确的是( )
| A. | Cl-离子的结构示意图: | B. | 白磷分子的比例模型: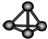 | ||
| C. | H2O2的结构式:H-O-O-H | D. | CCl4的电子式: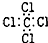 |
12.绿色能源是指使用不会对环境造成污染的能源.下列属于绿色能源的是( )
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①②⑥ |
11.氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
③下列关于合成氨说法正确是B(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.
0 167693 167701 167707 167711 167717 167719 167723 167729 167731 167737 167743 167747 167749 167753 167759 167761 167767 167771 167773 167777 167779 167783 167785 167787 167788 167789 167791 167792 167793 167795 167797 167801 167803 167807 167809 167813 167819 167821 167827 167831 167833 167837 167843 167849 167851 167857 167861 167863 167869 167873 167879 167887 203614
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.