8.在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.则( )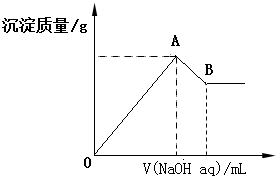

| A. | x=$\frac{2a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
7.在酸性Fe(NO3)3溶液中逐渐通入H2S气体,可能发生的离子反应是( )
| A. | H2S+2NO3-+2H+=2NO2↑+S↓+2H2O | |
| B. | 3 H2S+2NO3-+2H+=2NO↑+3S↓+4H2O | |
| C. | 3Fe3++3NO3-+6H2S=3NO↑+6S↓+3Fe2++6H2O | |
| D. | Fe3++3NO3-+5H2S+2H+=3NO↑+5S↓+Fe2++6H2O |
6.常温下,运用电离理论做出的预测正确的是( )
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
5.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,W是原子半径最大的短周期元素.下列判断正确的是( )
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
4.常温常压,将7.8g的Na2O2加入足量的1H218O中,反应完全后,有关物质的物理量正确的是( )
| A. | 转移的电子数是0.1NA | B. | 反应后液体质量减少1.6g | ||
| C. | 生成的气体中含有0.8mol中子 | D. | 生成气体的体积是1.12L |
3.下列实验目的能实现的是( )
| A. |  实验室制取乙炔 | B. |  实验室制取Fe(OH)2 | ||
| C. |  实验室制取少量氨气 | D. |  实验室制取乙酸丁酯 |
2.黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①2Cu2O+Cu2S→6Cu+SO2…②.则( )
| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
1.化学中常用图象直观地描述化学反应的进程或结果.只改变一个条件,则下列对图象的解读正确的是( )
0 167678 167686 167692 167696 167702 167704 167708 167714 167716 167722 167728 167732 167734 167738 167744 167746 167752 167756 167758 167762 167764 167768 167770 167772 167773 167774 167776 167777 167778 167780 167782 167786 167788 167792 167794 167798 167804 167806 167812 167816 167818 167822 167828 167834 167836 167842 167846 167848 167854 167858 167864 167872 203614
| A. | 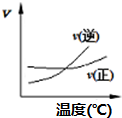 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 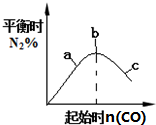 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. |  N2(g)+3H2(g)?2NH3(g)如图说明t秒时合成氨反应达到平衡 | |
| D. |  2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |

 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.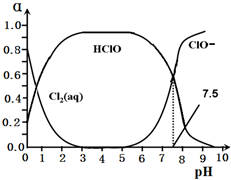 元素周期表中ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中ⅦA族元素的单质及其化合物的用途广泛.