8.酸碱中和滴定是最基本的定量分析化学实验,常温下,向50mL0.5mol•L-1HA溶液中逐滴加入强碱MOH溶液,图中所示曲线表示混合溶液的pH变化情况(条件变化忽略不计).下列叙述正确的是( )


| A. | 由图中信息可知HA为强酸,N点表示酸碱恰好中和 | |
| B. | 常温下,一定浓度的MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13.c(HA)+c(A-)=0.25mol•L-1 |
7.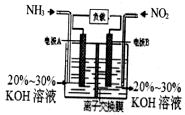 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
6.下列说法正确的是( )
| A. | 按系统命名法,有机物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| B. | 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色 | |
| C. | 等质量的苯、乙炔、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加 | |
| D. | 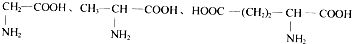 三种氨基酸之间脱水,最多可生成6种二肽 三种氨基酸之间脱水,最多可生成6种二肽 |
5.五种短周期主族元素如图所示,下列不正确的是( )
| X | L | Z |
| Y | W |
| A. | Y的原子半径一定比L的大 | |
| B. | 若X、Y为非金属元素,则X、Y元素形成的单质晶体类型一定相同 | |
| C. | 若X、W能组成XW型分子,则其空间构型分子,则其空间构型一定为直线型 | |
| D. | 对应简单氢化物的沸点可能是X>Y、Z>W |
4.化学与人类生活、生成和社会可持续发展密切相关,下列说法正确的是( )
| A. | 铜矿石在细菌作用下直接转换为单质铜,这个过程中叫做生物炼铜 | |
| B. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,相同条件下,某物质的热值越高,其标准燃烧越大 | |
| C. | 铅蓄电池是最常见的二次电池,可根据硫酸的密度来判断铅蓄电池是否需要充电 | |
| D. | “地沟油”禁止食用,但可以通过物理变化制肥皂 |
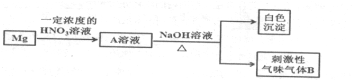
3.化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺.化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护.在ABS工程塑料表面进行化学镀镍的流程如下:

回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
由此推断,镀层厚度y与反应时间t的关系式为y=at1/2;欲使镀层厚度为6anm,需要的反应时间为36s.
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.
0 167670 167678 167684 167688 167694 167696 167700 167706 167708 167714 167720 167724 167726 167730 167736 167738 167744 167748 167750 167754 167756 167760 167762 167764 167765 167766 167768 167769 167770 167772 167774 167778 167780 167784 167786 167790 167796 167798 167804 167808 167810 167814 167820 167826 167828 167834 167838 167840 167846 167850 167856 167864 203614

回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
| 反应时间t/s | 1 | 4 | 9 | 16 |
| 镀层厚度y/nm | a | 2a | 3a | 4a |
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.
 ;
;
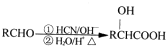
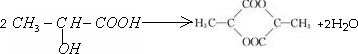 ;
; .
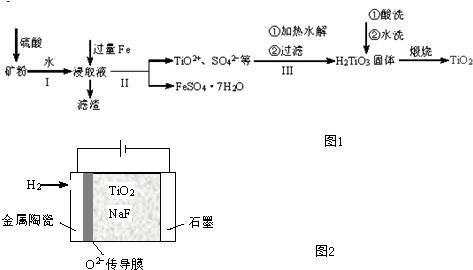
.
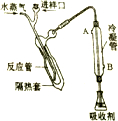 “凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:
“凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下: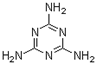 )
)