题目内容
8.酸碱中和滴定是最基本的定量分析化学实验,常温下,向50mL0.5mol•L-1HA溶液中逐滴加入强碱MOH溶液,图中所示曲线表示混合溶液的pH变化情况(条件变化忽略不计).下列叙述正确的是( )
| A. | 由图中信息可知HA为强酸,N点表示酸碱恰好中和 | |
| B. | 常温下,一定浓度的MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13.c(HA)+c(A-)=0.25mol•L-1 |
分析 0.5mol•L-1 HA溶液中pH=2,则HA是弱酸,N点时溶液呈中性,MOH的物质的量小于于HA的物质的量,MA是弱酸强碱盐,根据溶液的组成以及溶液中离子浓度的大小比较方法来回答.
解答 解:A、0.5mol•L-1 HA溶液中pH=2,则HA是弱酸,酸碱恰好中和,得到的MA是弱酸强碱盐,pH不等于7,故A错误;
B、MA是弱酸强碱盐,常温下,一定浓度的MA稀溶液的pH>7,故B错误;
C、常温下,向50mL0.5mol•L-1HA溶液中逐滴加入强碱MOH溶液100mL,此时MOH剩余,得到的是强碱和MA的混合物,溶液显示碱性,此时c(M+)>c(OH-)>c(A-)>c(H+),故C正确;
D、K点对应的溶液中,溶液的体积是150mL,根据物料守恒,此时c(HA)+c(A-)=$\frac{0.05L×0.5mol/L}{0.15L}$<0.25mol•L-1,故D错误.
故选C.
点评 本题考查了酸碱混合的定性判断及溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确盐的水解原理及其应用方法,正确分析图象曲线变化为解答关键.

练习册系列答案
相关题目
5.分别燃烧等物质的量的下列各组物质,其中消耗氧气量相等的是( )
①C2H2 与CH3CHO ②C7H8与C6H12 ③C2H2与C6H6④HCOOCH3与CH3COOH.
①C2H2 与CH3CHO ②C7H8与C6H12 ③C2H2与C6H6④HCOOCH3与CH3COOH.
| A. | ①②③④ | B. | ①②④ | C. | ①④ | D. | ②④ |
6.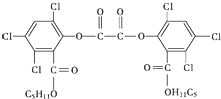 “魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )
 “魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )| A. | CPPO难溶于水 | |
| B. | CPPO属于芳香烃也属于高分子化合物 | |
| C. | 1 mol CPPO与氢气完全反应,需要10 mol H2 | |
| D. | 1 mol CPPO与NaOH稀溶液反应(不考虑苯环上氯原子水解),最多消耗4 mol NaOH |
3.反应2C+CO2(g)?2CO(g)达到化学平衡后,保持其他条件不变,移走少量CO,达到新的平衡后,下列选项中,增大的是( )
| A. | CO2和CO浓度比 | B. | 混合气体的密度 | C. | 转化率 | D. | CO 的体积分数 |
3.化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺.化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护.在ABS工程塑料表面进行化学镀镍的流程如下:

回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
由此推断,镀层厚度y与反应时间t的关系式为y=at1/2;欲使镀层厚度为6anm,需要的反应时间为36s.
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.

回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
| 反应时间t/s | 1 | 4 | 9 | 16 |
| 镀层厚度y/nm | a | 2a | 3a | 4a |
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.
13.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验1、2、3、4按下列表格药品用量实验,并都加水稀释至10mL,假设加水后两者开始反应(下面实验同),均在室温下观察溶液颜色褪去时间,并记录如下:
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示从反应开始至颜色褪色这段时间该反应的反应速率为:
υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验1、2、3、4按下列表格药品用量实验,并都加水稀释至10mL,假设加水后两者开始反应(下面实验同),均在室温下观察溶液颜色褪去时间,并记录如下:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示从反应开始至颜色褪色这段时间该反应的反应速率为:
υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
17.化学用语是学习化学的工具和基础.下列有关化学用语的使用正确的是( )
| A. | 食醋呈酸性的原因是:CH3COOH+H2O=CH3COO-+H3O+ | |
| B. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| C. | 用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O $\frac{\underline{\;电解\;}}{\;}$ Fe(OH)2+H2↑ | |
| D. | 表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ•mol-1 |
18.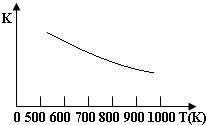 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )| A. | H2S是还原剂 | B. | 脱除H2S的反应是放热反应 | ||
| C. | 温度越高H2S的脱除率越大 | D. | 压强越小H2S的脱除率越高 |