18.下列实验目的能实现的是(部分夹持装置已略去)( )
| A. | 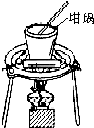 对溶液进行蒸发、浓缩、结晶 | |
| B. |  以己烯为萃取剂萃取溴水中的溴单质 | |
| C. | 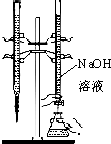 用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| D. | 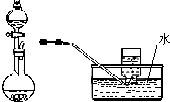 用稀硝酸与铜反应制取并收集NO |
15.下列四组物质,组内每种混合物都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水、植物油和水 | |
| B. | 四氯化碳和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙酸和乙醇、乙酸和水 | |
| D. | 水和植物油、己烷和水、苯和水 |
14.下列关于有机物的叙述错误的是( )
| A. | 石油气、煤油和石蜡的主要成分都是碳氢化合物 | |
| B. | 含碳的化合物不一定都是有机物 | |
| C. | 由CH2=CH-COOCH3合成的聚合物为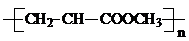 | |
| D. | 苯不具有典型双键所应具有的加成反应,故不可能发生加成反应 |
13.卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )
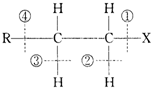

| A. | 该卤代烃发生水解反应时,被破坏的键是①和④ | |
| B. | 该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键是① | |
| D. | 当该卤代烃发生消去反应时,被破坏的键是①和② |
12.下列叙述正确的是( )
| A. | 正戊烷分子中的最多有5个原子在同一平面上 | |
| B. | 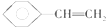 分子中最多有8个原子在同一平面上 分子中最多有8个原子在同一平面上 | |
| C. | CH2=CH-CH=CH2所有原子可能在同一直线上 | |
| D. | 2-丁烯(CH3CH=CHCH3)分子中4个碳原子可能在同一直线上 |
11.据报道,在欧洲一些国家发现饲料被污染,导致畜禽类制品及乳制品不能食用,经测定饲料中含有剧毒物质二恶英,其结构为  ,已知它的二氯代物有10种,则其六氯代物有( )
,已知它的二氯代物有10种,则其六氯代物有( )
 ,已知它的二氯代物有10种,则其六氯代物有( )
,已知它的二氯代物有10种,则其六氯代物有( )| A. | 15种 | B. | 11种 | C. | 10种 | D. | 5种 |
10.25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
0 167474 167482 167488 167492 167498 167500 167504 167510 167512 167518 167524 167528 167530 167534 167540 167542 167548 167552 167554 167558 167560 167564 167566 167568 167569 167570 167572 167573 167574 167576 167578 167582 167584 167588 167590 167594 167600 167602 167608 167612 167614 167618 167624 167630 167632 167638 167642 167644 167650 167654 167660 167668 203614
| A. | C2H4 | B. | C3H6 | C. | C2H6 | D. | C4H8 |
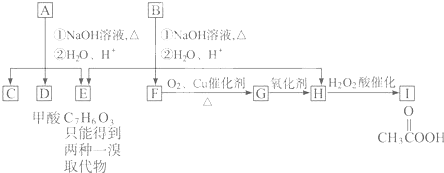
 A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
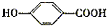 .
. 或
或 .
.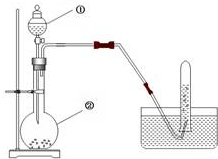 实验室用电石制取乙炔的装置如下图所示,请填空:
实验室用电石制取乙炔的装置如下图所示,请填空: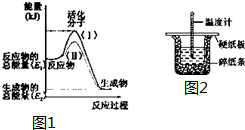 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.