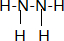20.甲、乙、丙、丁四种物质分别含两种或三种元素,它们的分子中各含l8个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液只能与酸反应 | |
| B. | 丁和甲中各元素质量比相同,则丁中一定含有-l价的元素 | |
| C. | 丙中含有第二周期ⅣA族的元素,则丙一定是只含C、H的化合物 | |
| D. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
19.四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
18.灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H=+2.1kJ/mol下列说法正确的是( )
| A. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 | |
| B. | 锡在常温下以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 灰锡和白锡的相互转化互为可逆反应 |
17.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: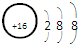 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: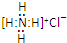 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+5 |
16.下列关于氯元素的说法正确的是( )
| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
14.鲍林(L.Pauling)首先提出了电负性的概念.电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,试回答下列问题:
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
13.已知X、Y、Z为同一周期的三种元素,其原子的部分电离能(kJ•mol-1)如下表所示:
下列说法正确的是( )
| 元素 电离能/kJ•mol-1 | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4 562 | 1 451 | 1 817 |
| I3 | 6 912 | 7 733 | 2 754 |
| I4 | 9 540 | 10 540 | 11 578 |
| A. | 三种元素中,X元素的第一电离能最小,其电负性在同一周期元素中也最小 | |
| B. | 三种元素中,Y元素的第一电离能最大,其电负性也最大 | |
| C. | 等物质的量的X、Y、Z三种单质与少量盐酸反应时放出的氢气的物质的量之比为1:1:1 | |
| D. | 三种单质与盐酸反应放出等量氢气时,消耗X、Y、Z的物质的量之比为3:2:1 |
12.某铝厂的有毒废水流入多瑙河分支,大量死鱼出现在拉巴河和多瑙河的交汇处,这里河水的pH高达9.1.为了拯救多瑙河的生态环境,必须将河水的pH降至8以下.因此可向河水中投入食醋、熟石膏(CaSO4)等来降低碱性.下列有关说法正确的是( )
0 167438 167446 167452 167456 167462 167464 167468 167474 167476 167482 167488 167492 167494 167498 167504 167506 167512 167516 167518 167522 167524 167528 167530 167532 167533 167534 167536 167537 167538 167540 167542 167546 167548 167552 167554 167558 167564 167566 167572 167576 167578 167582 167588 167594 167596 167602 167606 167608 167614 167618 167624 167632 203614
| A. | 在元素周期表中,铝的周期数是其主族序数的2倍 | |
| B. | 铝原子的基态电子排布图为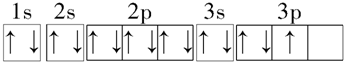 | |
| C. | 同周期,铝、钙所在主族的元素的原子序数之差只为1或11 | |
| D. | 工业上冶炼金属铝的方法是电解熔融的Al2O3 |