19. 2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.
2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.
(1)【知识回访】
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H)CuHgAg Pt Au.请你在横线上填写对应金属的元素符号.
(2)【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是Fe>Cr>Cu.
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
(3)【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
(4)【结论与解释】
小聪得到的结论是:猜想1正确.
(5)【知识运用】
将铬片投入FeSO4溶液中,反应能(填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式Cr+FeSO4=CrSO4+Fe.
 2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.
2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.(1)【知识回访】
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H)CuHgAg Pt Au.请你在横线上填写对应金属的元素符号.
(2)【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是Fe>Cr>Cu.
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
(3)【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 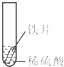 | 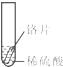 | 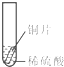 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜表面无气泡,溶液不变色 |
小聪得到的结论是:猜想1正确.
(5)【知识运用】
将铬片投入FeSO4溶液中,反应能(填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式Cr+FeSO4=CrSO4+Fe.
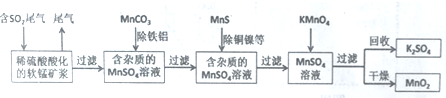
18.臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)?N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列有关说法正确的是( )
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
16.室温下,某研究小组为探究影响CaCO3与盐酸反应速率的因素,进行了如下实验.
(1)测定0.5mol•L-1盐酸与CaCO3固体的反应速率.
方案1:通过测定生成CO2的体积(或质量)和反应时间计算反应速率;
方案2:通过测定消耗CaCO3固体的质量和反应时间计算反应速率;
(2)探究固体表面积或反应物浓度对化学反应速率的影响.限选试剂与用品:0.5mol•L-1盐酸、块状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
①设计实验:在固体表面积或反应物浓度不同的条件下,通过如图1实验装置测定生成等质量CO2所需的时间(或相同时间内生成的CO2的质量)来直接体现反应速率大小.

②参照下表格式,拟定实验表格,完整体现实验方案(写出所选试剂的状态及体积,需测定的物理量数据可用字母表示).
(3)实验结束后,研究小组将0.1mol•L-1Na2CO3溶液缓慢滴加至实验1反应后的混合溶液中,研究产生沉淀的量,请在图2中画出产生沉淀的质量与滴加Na2CO3溶液体积之间关系的示意图.
(1)测定0.5mol•L-1盐酸与CaCO3固体的反应速率.
方案1:通过测定生成CO2的体积(或质量)和反应时间计算反应速率;
方案2:通过测定消耗CaCO3固体的质量和反应时间计算反应速率;
(2)探究固体表面积或反应物浓度对化学反应速率的影响.限选试剂与用品:0.5mol•L-1盐酸、块状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
①设计实验:在固体表面积或反应物浓度不同的条件下,通过如图1实验装置测定生成等质量CO2所需的时间(或相同时间内生成的CO2的质量)来直接体现反应速率大小.

②参照下表格式,拟定实验表格,完整体现实验方案(写出所选试剂的状态及体积,需测定的物理量数据可用字母表示).
 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |
15.T℃时,向2.0L恒容密闭容器中充入1.0molPCl5,发生下列反应:PCl5(g)?PCl3(g)+Cl2(g).经过一段时间达到平衡,反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
13.某化学兴趣小组在一次实验活动中发现钠能在二氧化碳中燃烧,他们对钠在二氧化碳气体中燃烧后生成的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
思考与交流:
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
0 167410 167418 167424 167428 167434 167436 167440 167446 167448 167454 167460 167464 167466 167470 167476 167478 167484 167488 167490 167494 167496 167500 167502 167504 167505 167506 167508 167509 167510 167512 167514 167518 167520 167524 167526 167530 167536 167538 167544 167548 167550 167554 167560 167566 167568 167574 167578 167580 167586 167590 167596 167604 203614
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O. |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCl2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中… | …. |
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.