4.乙酸的某种同系物Q存在同类型的同分异构体下列,有关Q的说法中正确的是( )
| A. | 分子式可能为C3H6O2 | |
| B. | 该物质不存在属于酯类的同分异构体 | |
| C. | 相对分子质量比乙酸大14n(n为整数) | |
| D. | 完全燃烧时生成CO2和H2O的质量比一定为11:9 |
3.25℃时,物质的量浓度相等的NaHCO3、CH3COONa混合溶液中,下列有关说法或粒子浓度关系正确的是(Ka表示CH3COOH的电离平衡常数).
| A. | pH可能等于7 | |
| B. | c(HCO3- )=c(CH3COO-) | |
| C. | c(OH-)=$\frac{c(C{H}_{3}COOH)Kw}{c(C{H}_{3}CO{O}^{-})Ka}$ | |
| D. | c(HCO3- )+c(H2CO3)+c(CO3 2-)=c(CH3COOH)+c(CH3COO-) |
20.下列说法不正确的是( )
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链含4个碳原子的结构有2种,则与其碳原子个数相同且主链有4个碳原子的单烯烃有4种 | |
| C. | 1mol 与NaOH溶液反应,最多消耗5molNaOH 与NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molβ-紫罗兰酮(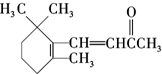 )与1molBr2发生加成反应得到3种不同产物 )与1molBr2发生加成反应得到3种不同产物 |
19.下列叙述中,正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 在周期表主族元素的最外层电子数等于其主族序数 | |
| D. | 元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素 |
18.下列各组原子序数所表示的两种元素,能形成AB2型共价化合物的是( )
| A. | 6和8 | B. | 1和7 | C. | 11和16 | D. | 12和17 |
17.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请回答下列问题:
(1)加入ZnO调节pH=a的目的是使溶液中的Fe3+完全沉淀,Zn2+不被沉淀,a的范围是3.0≤a<5.9.
(2)由不溶物E生成溶液D的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.
(3)滤液A中加入H2O2反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、过滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后沉淀溶解.

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)加入ZnO调节pH=a的目的是使溶液中的Fe3+完全沉淀,Zn2+不被沉淀,a的范围是3.0≤a<5.9.
(2)由不溶物E生成溶液D的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.
(3)滤液A中加入H2O2反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、过滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后沉淀溶解.
16.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].如图1是实验室模拟制备的操作流程:
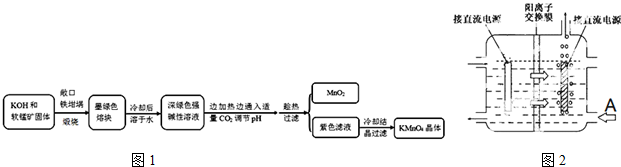
相关资料:
①物质溶解度
②锰酸钾[K2MnO4]外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
0 167268 167276 167282 167286 167292 167294 167298 167304 167306 167312 167318 167322 167324 167328 167334 167336 167342 167346 167348 167352 167354 167358 167360 167362 167363 167364 167366 167367 167368 167370 167372 167376 167378 167382 167384 167388 167394 167396 167402 167406 167408 167412 167418 167424 167426 167432 167436 167438 167444 167448 167454 167462 203614

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
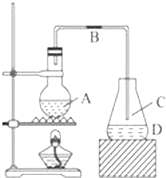 某化学课外小组用如图装置制取溴苯,请按要求完成下列小题:
某化学课外小组用如图装置制取溴苯,请按要求完成下列小题: .
. .
.