9.下列事实,不能用勒夏特列原理解释的是( )
| A. | 溴水中有平衡:Br2+H2O?HBr+HBrO 加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 | |
| C. | 高压比常压有利于合成SO3的反应 | |
| D. | 对CO(g)+NO2(g)?CO2(g)+NO(g) 平衡体系增大压强可使颜色变深 |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,18gD2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
7.下列说法错误的是( )
| A. | 原子半径:F<Mg<K | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<KOH |
6.同族元素所形成的同类型的化合物,其结构和性质往往相似.化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
5.下表是元素周期表的一部分( 注意:用元素符号或化学式填空)
(1)C的离子的结构示意图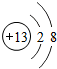 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
(2)H元素的单质的电子式 ;
;
(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程
(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
0 167247 167255 167261 167265 167271 167273 167277 167283 167285 167291 167297 167301 167303 167307 167313 167315 167321 167325 167327 167331 167333 167337 167339 167341 167342 167343 167345 167346 167347 167349 167351 167355 167357 167361 167363 167367 167373 167375 167381 167385 167387 167391 167397 167403 167405 167411 167415 167417 167423 167427 167433 167441 203614
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
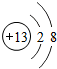 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3(2)H元素的单质的电子式
 ;
;(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程

(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
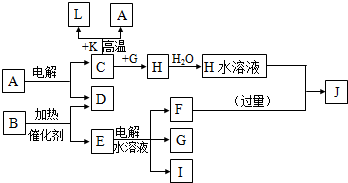
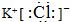 .
. 如图所示,
如图所示, .
.