题目内容
3.(1)向硫酸铜溶液中滴加氨水溶液中先生成蓝色沉淀,然后蓝色沉淀消失,溶液变为深蓝色,加入乙醇后,溶液中析出深蓝色晶体,写出该深蓝色晶体的化学式[Cu(NH3)4]SO4•H2O.(2)乙醇的结构简式所示:CH3-CH2-OH,分子中C、O原子的杂化方式分别为-CH3sp3,-CH2-sp3,-OHsp3.
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101KPa下,已知该反应每消耗1mol CuCl(s),放出44.4KJ,该反应的热化学方程式是4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
分析 (1)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4•H2O;
(2)根据C、O原子形成的共价键数和孤电子对数判断;
(3)该反应每消耗1mol CuCl(s),放热44.4kJ,消耗4mol CuCl(s),则放热44.4kJ×4=177.6kJ,根据热化学方程式的书写方法.
解答 解:(1)向深蓝色透明溶液加入乙醇,由于乙醇能降低溶解度,有利于晶体析出,所以[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,故会析出深蓝色的晶体:Cu(NH3)4SO4•H2O;
故答案为:Cu(NH3)4SO4•H2O;
(2)CH3-CH2-OH分子中,-CH3中C原子形成的4个单键,则价层电子对数为4,为sp3杂化,-CH2-中C原子形成的4个单键,则价层电子对数为4,为sp3杂化,-OH中O原子形成2个单键,还有2个孤电子对,则价层电子对数为4,为sp3杂化;
故答案为:sp3;sp3;sp3;
(3)该反应每消耗1mol CuCl(s),放热44.4kJ,消耗4mol CuCl(s),则放热44.4kJ×4=177.6kJ,根据热化学方程式的书写方法,可以写出该反应的热化学方程式为4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
点评 本题考查了配合物、价层电子对互斥理论的应用、热化学方程式的书写等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
13.在检验SO42-的过程中,下列操作中正确的是( )
| A. | 先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存 |
18.与NO3-互为等电子体的是( )
| A. | SO3 | B. | BF3 | C. | CH4 | D. | NO2 |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,18gD2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
15.元素的以下性质,随着原子序数递增不呈现周期性变化的是( )
| A. | 化合价 | B. | 原子半径 | ||
| C. | 元素的金属性和非金属性 | D. | 相对原子质量 |
13.下列化学性质中,烷烃不具备的是( )
| A. | 能使溴水褪色发生加成反应 | B. | 可以在空气中燃烧 | ||
| C. | 与Cl2发生取代反应 | D. | 能使酸性KMnO4溶液褪色 |
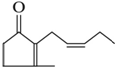 有机化合物A是人工合成的香料茉莉酮,其结构简式如图:
有机化合物A是人工合成的香料茉莉酮,其结构简式如图: .
.