题目内容
10.已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图.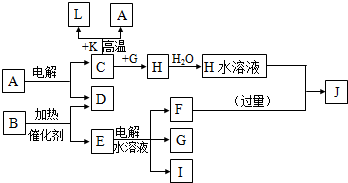
请回答:
(1)工业上制C用A不用H的原因氯化铝是共价化合物,熔融状态下不导电.
(2)写出C与K反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应的反应物总能量大于(填“大于”或“小于”)生成物总能量.
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑.
(4)写出E物质的电子式
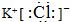 .
.(5)J与H反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓.
(6)写出G与熟石灰反应制取漂白粉的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
分析 D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2,K为红棕色固体粉末,应为Fe2O3,由于电解A得到C与D,则C与K生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al,黄绿色气体G为Cl2,与C反应得到H为AlCl3,B的焰色反应呈紫色(透过蓝色钴玻璃),含有K元素,B在二氧化锰加热条件下反应生成氧气,则B为KClO3,E为KCl,电解可生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2,结合对应物质的性质以及题目要求解答该题.
解答 解:D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2,K为红棕色固体粉末,应为Fe2O3,由于电解A得到C与D,则C与K生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al,黄绿色气体G为Cl2,与C反应得到H为AlCl3,B的焰色反应呈紫色(透过蓝色钴玻璃),含有K元素,B在二氧化锰加热条件下反应生成氧气,则B为KClO3,E为KCl,电解可生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2,
(1)氯化铝是共价化合物,熔融状态下不导电,故工业上制Al用氧化铝不用氯化铝,
故答案为:氯化铝是共价化合物,熔融状态下不导电;
(2)C与K反应的化学方程式为:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;大于;
(3)Fe是目前应用最广泛的金属,用碳棒作阳极,Fe作阴极,接通电源(短时间)电解KCl水溶液的化学方程式为:2KCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑,
故答案为:2KCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑;
(4)E为KCl,E物质的电子式为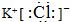 ,故答案为:
,故答案为: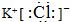 ;
;
(5)J与H反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(6)G为Cl2,G与熟石灰反应制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查无机推断等,特殊颜色及D的原子结构、转化关系中特殊反应等是推断突破口,是对元素化合物知识及学生综合能力的考查,需对基础知识全面掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| C. | 醋酸与锌反应所需时间长 | |
| D. | 盐酸和醋酸分别与锌反应所需时间一样长 |
| A. | SO3 | B. | BF3 | C. | CH4 | D. | NO2 |
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
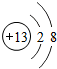 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3(2)H元素的单质的电子式
 ;
;(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程

(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
| A. | 化合价 | B. | 原子半径 | ||
| C. | 元素的金属性和非金属性 | D. | 相对原子质量 |
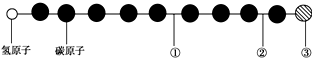
| A. | ①处的化学键是碳碳双键 | B. | ②处的化学键是碳碳三键 | ||
| C. | ③处的原子可能是氯原子或氟原子 | D. | ②处的化学键是碳碳单键 |
| A. | 黄铜 | B. | 不锈钢 | C. | 紫铜 | D. | 生铁 |