19.下列实验不合理的是( )
| A. | 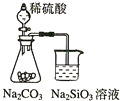 证明非金属性强弱 S>C>Si | B. | 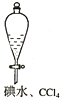 四氯化碳萃取碘水中的碘 | ||
| C. | 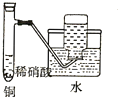 制备并收集少量NO气体 | D. | 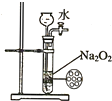 制备少量氧气 |
18.某有机物X的结构简式如图所示,则下列有关说法中正确的是( )


| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
12.己烯雌酚是一种激素类药物,结构如下:
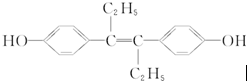
,下列有关叙述中不正确的是( )

,下列有关叙述中不正确的是( )
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3溶液发生反应 | |
| C. | 该有机物分子中一定有14个碳原子共平面 | |
| D. | 1 mol该有机物可与5 mol Br2发生反应 |
11.可用于区别苯、甲苯、苯酚、四氯化碳四种无色液体,所选试剂正确的一组为( )
0 167244 167252 167258 167262 167268 167270 167274 167280 167282 167288 167294 167298 167300 167304 167310 167312 167318 167322 167324 167328 167330 167334 167336 167338 167339 167340 167342 167343 167344 167346 167348 167352 167354 167358 167360 167364 167370 167372 167378 167382 167384 167388 167394 167400 167402 167408 167412 167414 167420 167424 167430 167438 203614
| A. | 氯化铁溶液、溴水 | B. | NaOH溶液、溴水 | ||
| C. | 高锰酸钾溶液、溴水 | D. | NaHCO3溶液、溴水 |
 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
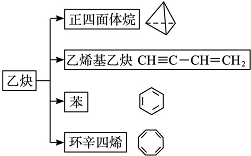
 .
.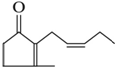 有机化合物A是人工合成的香料茉莉酮,其结构简式如图:
有机化合物A是人工合成的香料茉莉酮,其结构简式如图: