13.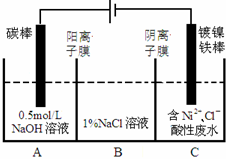 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )
 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )
| A. | 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O | |
| B. | 为了提高Ni的产率,电解过程中需要控制废水pH | |
| C. | 电解过程中,B中NaCl溶液的物质的量浓度将不断减小 | |
| D. | 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
11. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
请回答下列问题.
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
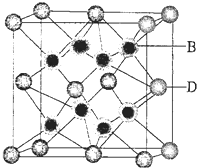
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
10. 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
9.对下列装置作用的分析或解释正确的是( )
| A. | 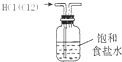 装置可除去HCl中的Cl2杂质 | |
| B. | 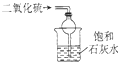 装置可吸收SO2,并防止倒吸 | |
| C. | 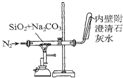 装置石灰水变浑浊即可证明非金属性:Si>C | |
| D. |  装置可制取并收集NO气体 |
8.有关下列图象的分析错误的是( )
| A. | 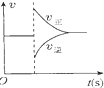 图可表示对平衡N2+3H2?2NH3加压、同时移除部分NH3时的速率变化 | |
| B. | 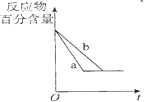 图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 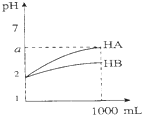 图表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况.若2<a<5,则两酸都为弱酸 | |
| D. | 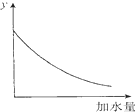 图中的y可表示将O.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况 |
7.已知下列物质在20℃下的Ksp如下:
下列说法不正确的是( )
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0X10-10 | 5.4X10-13 | 8.3X10-17 | 2.0X10-41 | 2.0X10-12 |
| A. | 20℃时.AgCl饱和溶液和Ag2CrO4饱和溶液中.Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl | |
| B. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.会先生成浅黄色沉淀 | |
| C. | 20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,当两种沉淀共存时.c(Br-):C(C1-)=2.7×10-3 | |
| D. | 在100ml AgCl、AgBr、AgI饱和的混合溶液中加入足量浓AgNO3溶液,产生沉淀AgI质量最多 |
5.下列实验操作或叙述正确的是( )
0 167196 167204 167210 167214 167220 167222 167226 167232 167234 167240 167246 167250 167252 167256 167262 167264 167270 167274 167276 167280 167282 167286 167288 167290 167291 167292 167294 167295 167296 167298 167300 167304 167306 167310 167312 167316 167322 167324 167330 167334 167336 167340 167346 167352 167354 167360 167364 167366 167372 167376 167382 167390 203614
| A. | 通过导电实验证明氢氧化铁胶体带正电 | |
| B. | 除去苯中溶有的少量乙醇,加入水,振荡,然后分液 | |
| C. | 进行蒸馏操作时.应用温度计准确测量沸腾液体的温度 | |
| D. | 从海带中提取碘时用到的药品有双氧水和NaOH溶液 |
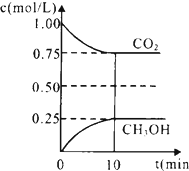 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
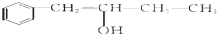
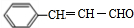
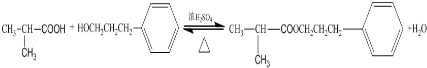 ,该反应类型为酯化反应:
,该反应类型为酯化反应: