题目内容
5.下列实验操作或叙述正确的是( )| A. | 通过导电实验证明氢氧化铁胶体带正电 | |
| B. | 除去苯中溶有的少量乙醇,加入水,振荡,然后分液 | |
| C. | 进行蒸馏操作时.应用温度计准确测量沸腾液体的温度 | |
| D. | 从海带中提取碘时用到的药品有双氧水和NaOH溶液 |
分析 A、胶体不带电;
B、乙醇能和水以任意比混溶;
C、蒸馏操作时,温度计水银球应位于蒸馏烧瓶的支管口处;
D、双氧水在酸性条件下氧化I-.
解答 解:A、胶体不带电,胶粒带电,故A错误;
B、乙醇能和水以任意比混溶,故可以用水洗的方法来除去苯中的乙醇,故B正确;
C、蒸馏操作时,温度计测量的是蒸汽的温度,故水银球应位于蒸馏烧瓶的支管口处,故C错误;
D、双氧水在酸性条件下氧化性比较强,且氧化生成的碘单质在碱性条件下不能存在,故应在酸性条件下氧化I-,故从海带中提取碘时用到的药品有双氧水和硫酸溶液,故D错误.
故选B.
点评 本题考查了胶体的性质和物质的除杂分离操作,难度不大,注意知识的积累.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
15.下列仪器中,能在酒精灯上直接加热的是( )
| A. | 试管 | B. | 烧杯 | C. | 量筒 | D. | 集气瓶 |
16.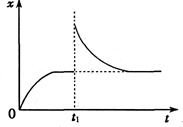 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )| A. | v逆 | B. | c(CO2) | C. | △H | D. | ρ(容器内气体密度) |
20.用NA一表示阿伏加德罗常数的值.下列判断错误的是( )
| A. | NA个H+的质量为1g | |
| B. | 32g O2中含有2NA个O原子 | |
| C. | 2 L 0.5mol/LNa2SO4溶液中含NA个Na+ | |
| D. | 标准状况下,1 molH2O中含有10NA个质子 |
10. 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
17.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 标准状况下,22.4 L氧气作氧化剂时转移电子数为4NA |
14.下列反应的离子方程式书写错误的是( )
| A. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH-=CaCO3↓+BaCO3↓+2H2O | |
| B. | 3molCl2通入含2molFeI2的溶液中:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2 | |
| C. | 往Ba(OH)2溶液中逐滴加入NH4Al(SO4)2溶液,可能发生反应的离子方程式是Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓ | |
| D. | 向苯酚钠溶液中通入少量的CO2: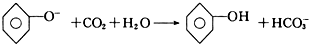 |
15.关于核素${\;}_{16}^{34}$S的叙述错误的是( )
| A. | 质量数为34 | B. | 中子数为18 | ||
| C. | S2-核外电子数为18 | D. | 原子最外层电子数16 |
 .
.