4.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(2)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)再次假设,黑色沉淀是铜的硫化物.实验如下:
①现象2说明黑色沉淀具有还原性.
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(4)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(2)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
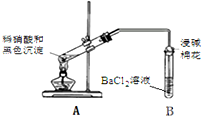 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(4)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
3. 某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
【提出假设】:
小组同学经过分析讨论认为生成气体可能含H2和SO2.
【设计实验方案,验证假设】主要包括两个环节:
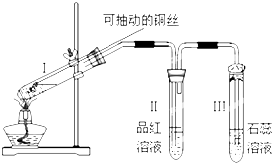
Ⅰ.验证SO2,实验装置如图所示;
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置C、D、E、F、G.Ⅱ中装置C、D、E、F、G的信息如表所示:
试回答下列问题:
(1)小组同学认为生成气体中含H2的理由是随着反应的进行,硫酸的浓度变小;
(2)盛放锌粒的仪器名称是蒸馏烧瓶;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是品红溶液先褪色,加热后又恢复红色;
(4)①装置D、G的作用依次是干燥H2,防止干扰后面H2的检验、防止空气中的水蒸气进入H;
②E中发生反应的化学方程式是CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
③试剂X是无水CuSO4粉末.
 某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.【提出假设】:
小组同学经过分析讨论认为生成气体可能含H2和SO2.
【设计实验方案,验证假设】主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示;
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置C、D、E、F、G.Ⅱ中装置C、D、E、F、G的信息如表所示:
| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
(1)小组同学认为生成气体中含H2的理由是随着反应的进行,硫酸的浓度变小;
(2)盛放锌粒的仪器名称是蒸馏烧瓶;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是品红溶液先褪色,加热后又恢复红色;
(4)①装置D、G的作用依次是干燥H2,防止干扰后面H2的检验、防止空气中的水蒸气进入H;
②E中发生反应的化学方程式是CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
③试剂X是无水CuSO4粉末.
18.下列各项操作中,会导致液体分散系颜色发生两次显著变化的是( )
0 167179 167187 167193 167197 167203 167205 167209 167215 167217 167223 167229 167233 167235 167239 167245 167247 167253 167257 167259 167263 167265 167269 167271 167273 167274 167275 167277 167278 167279 167281 167283 167287 167289 167293 167295 167299 167305 167307 167313 167317 167319 167323 167329 167335 167337 167343 167347 167349 167355 167359 167365 167373 203614
| A. | AlCl3溶液中滴加足量氨水 | |
| B. | 向酚酞试液中通入过量Cl2 | |
| C. | 向紫色石蕊试液中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |

 .
. 实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
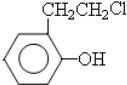
实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫. ,其中含氧官能团名称是羟基.
,其中含氧官能团名称是羟基.
 ,
,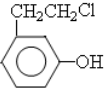 .
.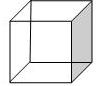 “立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示
“立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示 .
.