17.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.
Ⅰ、工业上一般以铁矿石、焦炭、石灰石和空气等为原料在高炉中炼制生铁
(1)高炉炼铁过程中加入石灰石的主要目的是将矿石中的二氧化硅等转变为炉渣.
(2)写出在高炉中铁矿石(以磁铁矿为例)被还原成单质铁的化学方程式Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2.
Ⅱ、碱式硫酸铁[Fe(OH)SO4]是一种用语污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(3)写出反应Ⅰ中发生的置换反应的离子方程式Fe+2H+═Fe2++H2↑.
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若通入2.8LO2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe(OH)SO4]2-聚合离子,该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
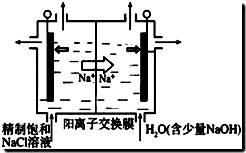
Ⅲ、铁的化合物也是制备高能锂电池的重要材料,已知LiFePO4电池反应为FePO4+Li$\frac{放电}{充电}$LiFePO4,电池中的固体电解质可传到Li+写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,溶液的pH值为13(忽略溶液的体积变化).
Ⅰ、工业上一般以铁矿石、焦炭、石灰石和空气等为原料在高炉中炼制生铁
(1)高炉炼铁过程中加入石灰石的主要目的是将矿石中的二氧化硅等转变为炉渣.
(2)写出在高炉中铁矿石(以磁铁矿为例)被还原成单质铁的化学方程式Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2.
Ⅱ、碱式硫酸铁[Fe(OH)SO4]是一种用语污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若通入2.8LO2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe(OH)SO4]2-聚合离子,该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ、铁的化合物也是制备高能锂电池的重要材料,已知LiFePO4电池反应为FePO4+Li$\frac{放电}{充电}$LiFePO4,电池中的固体电解质可传到Li+写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,溶液的pH值为13(忽略溶液的体积变化).
16.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应片刻后速率:X>Y |
13.对于CCl2F2(商品名称是氟利昂-12),下列有关叙述正确的是( )
| A. | 有两种同分异构体 | B. | 是非极性分子 | ||
| C. | 只有一种结构,无同分异构体 | D. | 是一种制冷剂 |
12.同系物具有( )
①相同的通式 ②相同的物理性质 ③相似的化学性质 ④相似的结构特征 ⑤不同的分子式.
①相同的通式 ②相同的物理性质 ③相似的化学性质 ④相似的结构特征 ⑤不同的分子式.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②④⑤ |
11.如表所示的五种元素中,甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素.下列说法正确的是
( )
( )
| 甲 | 乙 | ||
| 丙 | 丁 | ||
| 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 丁和戊的原子核外电子数相差8 | |
| C. | 最高价氧化物对应的水化物的酸性:丙>丁 | |
| D. | 甲的单质在空气中燃烧生成只含共价键的化合物 |
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 某酸雨试样中加入Ba(OH)2溶液 | 产生白色沉淀 | 酸雨试样中只含SO42- |
| C | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| D | 食用加碘盐加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐含有KIO3 |
| A. | A | B. | B | C. | C | D. | D |
8.313K时,水的Kw=3.0×10-14,则在313K时,c(H+)=10-7 mol/L的溶液( )
0 167176 167184 167190 167194 167200 167202 167206 167212 167214 167220 167226 167230 167232 167236 167242 167244 167250 167254 167256 167260 167262 167266 167268 167270 167271 167272 167274 167275 167276 167278 167280 167284 167286 167290 167292 167296 167302 167304 167310 167314 167316 167320 167326 167332 167334 167340 167344 167346 167352 167356 167362 167370 203614
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
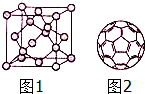 碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.
碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.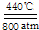 2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).
2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).