题目内容
11.如表所示的五种元素中,甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素.下列说法正确的是( )
| 甲 | 乙 | ||
| 丙 | 丁 | ||
| 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 丁和戊的原子核外电子数相差8 | |
| C. | 最高价氧化物对应的水化物的酸性:丙>丁 | |
| D. | 甲的单质在空气中燃烧生成只含共价键的化合物 |
分析 甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素,则乙为O元素,由元素在周期表中的相对位置可知,甲为C元素,丙为P元素,丁为Cl,戊为Br.
A.同周期随原子序数增大,原子半径减小;
B.Cl原子核外电子数为17,Br原子核外电子数为35;
C.非金属性越强,最高价含氧酸的酸性越强;
D.碳在空气中燃烧生成CO或二氧化碳.
解答 解:甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素,则乙为O元素,由元素在周期表中的相对位置可知,甲为C元素,丙为P元素,丁为Cl,戊为Br.
A.同周期随原子序数增大,原子半径减小,故原子半径:甲>乙,故A正确;
B.Cl原子核外电子数为17,Br原子核外电子数为35,二者核外电子数相差35-17=18,故B错误;
C.非金属性Cl>P,非金属性越强,最高价含氧酸的酸性越强,故酸性:高氯酸>磷酸,故C错误;
D.碳在空气中燃烧生成CO或二氧化碳,二者均为共价化合物,只含有共价键,故D正确,
故选AD.
点评 本题考查结构性质位置关系应用,难度不大,需要学生熟练掌握元素周期表结构晕元素周期律.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
1.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )

| A. | 产生气体的体积:①>② | |
| B. | 两极上析出物质的质量:①>② | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①中阳极:4OH--→2H2O+O2↑+4e-;②中阴极:2H++2e--→H2↑ |
6.水的电离过程为H2O?H++OH-,在不同温度下其离子积为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14,则下列叙述中正确的是( )
| A. | c(H+)随温度的升高而降低 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 溶液pH:pH(35℃)>pH(25℃) | |
| D. | 35℃时已电离的水的浓度约为1.45×10-7 mol/L |
16.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应片刻后速率:X>Y |
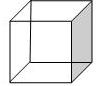 “立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示
“立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示 .
.