7.下列有关碱金属铷(Rb)的叙述中,不正确的是( )
| A. | Rb2CO3易溶、易电离 | |
| B. | Rb位于周期表第五周期第ⅠA族 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷和盐酸反应的离子方程式是OH-+H+═H2O |
6. 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )
某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:A(s)+3B(g)?2C(g)+D(g);△H<0,在一定温度和压强下达到平衡.若平衡时C的物质的量与加入B的物质的量的变化关系如图所示.则下列说法中正确的是( )| A. | 若保持压强不变,降低温度时,图中角度a将变小 | |
| B. | 若增大压强,缩小容器的体积,平衡向正反应方向移动 | |
| C. | 若保持压强不变,再通入B,则再次达到平衡时正、逆反应速率均增大 | |
| D. | 平衡时B、C的物质的量之比为1:2 |
5.下列各组离子在指定的溶液中不能大量共存的是( )
| A. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| B. | 1 mol•L-1的烧碱溶液中:S2-、SO32-、SO42-、K+ | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:Cs+、Ba2+、S2-、Cl- | |
| D. | 含有大量HCO3-的澄清透明溶液中:K+、NH4+、SO42-、MnO4- |
4.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式: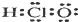 | B. | 氯化钠的分子式:NaCl | ||
| C. | 二氧化碳的比例模型: | D. | Cl-的结构示意图: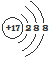 |
3.下列装置或操作不能达到实验目的是( )
| A. | 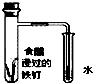 铁丝的析氢腐蚀实验 | B. | 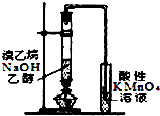 检验该反应的有机产物 | ||
| C. | 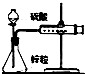 结合秒表测量锌与硫酸的反应速率 | D. | 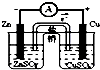 验证化学能转化为电能 |
2.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A. | 将0.1 mol•L-1的醋酸加水不断稀释,c(OH-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
1.下列说法正确的是( )
| A. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| B. | 桶烯(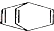 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 | |
| C. | 1.0mol的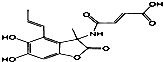 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H25.0mol | |
| D. | 按系统命名法,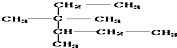 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 |
20.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,VL CHCl3含有的碳原子数为$\frac{V}{22.4}$NA | |
| B. | 常温常压下,1mol乙基所含的电子总数为17NA | |
| C. | 12g C60中含有60NA个电子 | |
| D. | 1mol HNO3见光分解,转移电子数为4NA |
19.室温下,pH值相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加水稀释2倍后,两溶液的pH均减小 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加适量的醋酸钠晶体后,两溶液的pH均增大 | |
| D. | 加足量的锌充分反应后,醋酸和盐酸产生的氢气一样多 |
18.按要求写出以下方程式:
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
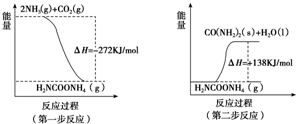
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式: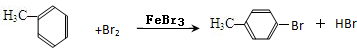 或
或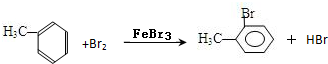
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
0 167157 167165 167171 167175 167181 167183 167187 167193 167195 167201 167207 167211 167213 167217 167223 167225 167231 167235 167237 167241 167243 167247 167249 167251 167252 167253 167255 167256 167257 167259 167261 167265 167267 167271 167273 167277 167283 167285 167291 167295 167297 167301 167307 167313 167315 167321 167325 167327 167333 167337 167343 167351 203614
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
 或
或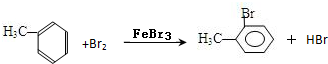
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.