题目内容
3.下列装置或操作不能达到实验目的是( )| A. | 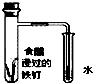 铁丝的析氢腐蚀实验 | B. | 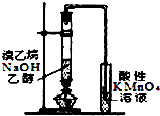 检验该反应的有机产物 | ||
| C. | 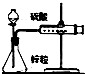 结合秒表测量锌与硫酸的反应速率 | D. | 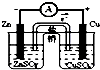 验证化学能转化为电能 |
分析 A.弱酸性电解质,发生析氢腐蚀;
B.溴乙烷与NaOH醇溶液发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
C.秒表测定时间,针筒测定气体的体积;
D.图中装置发生Zn与硫酸铜的电池反应.
解答 解:A.食醋具有弱酸性,Fe发生析氢腐蚀,正极上生成氢气,故A正确;
B.溴乙烷与NaOH醇溶液发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则不能检验乙烯的生成,故B错误;
C.秒表测定时间,针筒测定气体的体积,则图中装置可测量锌与硫酸的反应速率,故C正确;
D.图中装置发生Zn与硫酸铜的电池反应,Zn为负极,Cu为正极,利用盐桥形成闭合回路,装置可验证化学能转化为电能,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及电化学、有机物的结构与性质、反应速率测定等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
14.有一化学反应:aA+bB?C,根据影响化学反应速率的因素可得v0=kcm(A)cn(B),其中k是与温度有关的常数,为测得k、m、n的值,在298K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
(1)依表中数据可求得m=1,n=2,k=1.2×10-2,k的单位是L2•mol-2•s-1.
(2)若a=m,b=n,当c(A)=c(B)=2.0mol•L-1时,求以B表示的初始反应速率.
| 编号 | A的初$\frac{始浓度}{mol•{L}^{-1}}$ | B的初$\frac{始浓度}{mol•{L}^{-1}}$ | 生成C的$\frac{初始速率}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
(2)若a=m,b=n,当c(A)=c(B)=2.0mol•L-1时,求以B表示的初始反应速率.
18.按要求写出以下方程式:
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
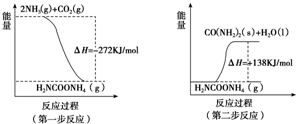
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式: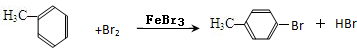 或
或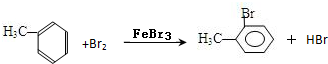
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
 或
或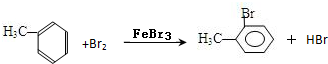
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
8.下列实验操作正确且能达到目的是( )
| A. | 将AlCl3溶液蒸发结晶提取无水AlCl3 | |
| B. | 用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 | |
| C. | 在温水瓶中加入Na2CO3溶液泡浸后加入盐酸除去内壁上CaSO4 | |
| D. | 将Cl2、HCl混合气体通过盛有NaHCO3饱和溶液的洗气瓶除去HCl |
15.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和(CuSO4) |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,下列所表示的化学反应速率中最大的是( )
| A. | v(A2)=0.8 mol/(L•s) | B. | v(A2)=60 mol/(L•min) | ||
| C. | v(AB3)=1.0 mol/(L•s) | D. | v(B2)=1.2 mol/(L•s) |
13.有不纯的CuCl2 1.35g,与足量的AgNO3溶液反应,可生成2.9g沉淀,则该氯化铜中所含的杂质可能是下列中的( )
| A. | ZnCl2 | B. | KCl | C. | NaCl | D. | BaCl2 |
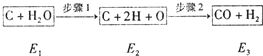 碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:
碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题: